概念
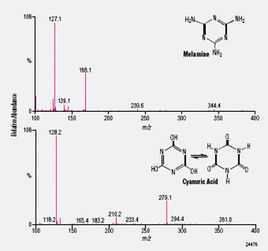
 質譜圖
質譜圖在質譜圖中,橫坐標表示離子的質荷比(m/z)值,從左到右質荷比的值增大,對於帶有單電荷的離子,橫坐標表示的數值即為離子的質量;縱坐標表示離子流的強度,通常用相對強度來表示,即把最強的離子流強度定為100%,其它離子流的強度以其百分數表示,有時也以所有被記錄離子的總離子流強度作為100%,各種離子以其所占的百分數來表示。
主要離子峰
從有機化合物的質譜圖中可以看到許多離子峰,這些峰的m/z和相對強度取決於分子結構,並與儀器類型,實驗條件有關。質譜中主要的離子峰有分子離子峰、碎片離子峰、同位素離子峰、重排離子峰及亞穩離子峰等。正是這些離子峰給出了豐富的質譜信息,為質譜分析法提供依據。下面對這些離子峰進行簡要介紹。
分子離子峰
分子受電子束轟擊後失去一個電子而生成的離子M稱為分子離子,例如:M+e→M+2e。
在質譜圖中由M所形成的峰稱為分子離子峰。因此,分子離子峰的m/z值就是中性分子的相對分子質量Mr,而Mr是有機化合物的重要質譜數據。
分子離子峰的強弱,隨化合物結構不同而異,其強弱一般為:芳環>醚>酯>胺>酸>醇>高分子烴。分子離子峰的強弱可以為推測化合物的類型提供參考信息。
碎片離子峰
當電子轟擊的能量超過分子離子電離所需要的能量時(約為50~70eV),可能使分子離子的化學鍵進一步斷裂,產生質量數較低的碎片,稱為碎片離子。在質譜圖上出現相應的峰,稱為碎片離子峰。碎片離子峰在質譜圖上位於分子離子峰的左側。
同位素離子峰
在組成有機化合物的常見十幾種元素中,有幾種元素具有天然同位素,如C,H,N,O,S,Cl,Br等。所以,在質譜圖中除了最輕同位素組成的分子離子所形成的M峰外,還會出現一個或多個重同位素組成的分子離子峰,如(M+1)、(M+2)、(M+3)等,這種離子峰叫做同位素離子峰。對應的m/z為M+1、M+2、M+3表示。人們通常把某元素的同位素占該元素的原子質量分數稱為同位素豐度。同位素峰的強度與同位素的豐度是相對應的,下表列出了有機化合物中元素的同位素豐度及峰類型。由下表可見,S、Cl、Br等元素的同位素豐度高,因此,含S、C、Br等元素的同位素其M+2峰強度較大。一般根據M和M+2兩個峰的強度來判斷化合物中是否含有這些元素。
有機化合物中常見元素的天然同位素豐度和峰類型
同位素相對豐度/%峰類型
H 99.985 M
H 0.015 M+1
C 98.893 M
C1.107 M+1
N 99.634 M
N 0.366 M+1
O 99.759 M
O 0.037 M+1
O 0.204 M+2
S 95.00 M
S 0.76 M+1
S 4.22 M+2
Cl 75.77 M
Cl 24.23 M+2
Br 50.537 M
Br 49.463 M+2
重排離子峰
分子離子裂解成碎片時,有些碎片離子不是僅僅通過鍵的簡單斷裂有時還會通過分子內某些原子或基團的重新排列或轉移而形成離子,這種碎片離子稱為重排離子.質譜圖上相應的峰稱為重排峰。
重排的方式很多,其中最重要的是麥氏重排(Mclafferty Rearrangement)。可以發生麥氏重排的化合物有醛、酮、酸、酯等。這些化合物含有C=X(X為O,S,N,C)基團,當與此基團相連的鍵上具有γ氫原子時,氫原子可以轉移到X原子上,同時β鍵斷裂。例如,正丁醛的質譜圖中出現很強的m/z=44峰,就是麥氏重排所形成的。
亞穩離子峰
前面所闡述的離子都是穩定的離子。實際上,在電離、裂解、重排過程中有些離子處於亞穩態。例如,在離子源中生成質量為m1的離子,在進入質量分析器前的無場飛行時發生斷裂,使其質量由m1變為m2,形成較低質量的離子。這類離子具有質量為m1離子的速度,進入質量分析器是具有m2的質量,在磁場作用下,離子運動的偏轉半徑大,它的表觀質量m*=[m2]^2/m1,這類離子叫亞穩離子,m*形成的質譜峰叫亞穩離子峰,在質譜圖上,m*峰不在m2處,而出現在比m2更低的m*處。
由於在無場區裂解的離子m*不能聚焦與一點,故在質譜圖上m*峰弱而鈍一般可能跨2~5個質量單位,並且m/z常常為非整數,所以m*峰不難識別。例如,在十六烷的質譜圖中,有若干個亞穩離子峰,其m/z分別位於32.9、29.5、28.8、25.7、21.7處。m/z=29.5的m*,因41^2/57≈29.5,所以m*=29.5表示存在如下裂解機理:C4H9→C3H5 + CH4m/z=57 m/z=41
由此可見,根據m1和m2就可計算m*,並證實有m1→m2的裂解過程,這對解析一個複雜質譜圖很有參考價值。
總結
通過質譜圖可以獲得豐富的質譜信息:各種碎片離子元素的組成,根據亞穩離子確定分子離子與碎片離子,碎片離子與碎片離子之間的關係,分子裂解方式與分子結構之間的關係等。通過m/z峰及其強度,可以進行有機化合物的相對分子質量的測定,確定化合物的化學式、結構式,並進行定量分析。