反應類型
在水溶液中,有幾類質子轉移反應。
一類是兩種不帶電荷的中性分子相反應,產生兩種帶相反電荷的離子。
例如:HO+NH→OH +NH
一類是一種離子與一種中性分子相反應,產生另一‘種離子和另一種中性分子。
例如:NH +HO→NH+HO
一類是一種離子與一種中性分子相反應,產生兩種離子。
例如:HCO +HO→CO +HO
一類是一種兩性溶劑的兩個分子之間相反應,其中一個是質子供體,一個是質子受體。
例如:H2O+H2O→H3O+OH-
這種反應稱為自動離解反應。由上式看到,水的自動離解可以產生氫離子。
製取弱酸和弱鹼
化學家歷來認為:“為了製備一個弱酸,就要把一個強酸加到這個弱酸的鹽中去。”這個規律是對的。當強酸與弱酸鹽反應時,強酸向弱酸的共軛鹼(弱酸根離子)給出一個質子而生成相應的弱酸。若在醋酸、氰化氫、硫化氫或碳酸的可溶性鹽中加入硫酸或鹽酸,就立即得到相應的弱酸:
HO +CHCOO →CHCOOH+HO
HO +CN →HCN+HO
HO +HS →HS
HO +HCO →HCO+HO
因為水化氫離子比右邊各酸都強,所以各反應都能向右進行。當達到右邊各酸的飽和溶解度時,氰化氫氣體、硫化氫氣體或二氧化碳(碳酸分解產生)就放出來了。所發生的硫化氫和二氧化碳,可以作為鑑定氫硫化物(以及硫化物)和酸式碳酸鹽(以及碳酸鹽)的特徵反應產物。這些反應確實可以認為是中和反應,因為反應的生成物之一總是水。
銨離子和甲基銨離子則能夠中和強鹼而生成氨或相應的胺類:
NH +OH →HO+NH
CHNH +OH →HO+CHNH
質譜法
質子轉移反應質譜法(英語:Proton-transfer-reaction mass spectrometry,縮寫:PTR-MS),是一種使用氣相水合氫離子作為離子源試劑的分析化學方法。使用質子轉移反應質譜法進行分析的儀器稱為質子轉移反應質譜儀。
1995年,因斯布魯克大學粒子物理研究所的科學家們發明了這一分析方法。PTR-MS多用於環境空氣中的揮發性有機物的實時監測。質子轉移反應質譜儀通常由一個與漂移管直接連線的離子源以及分析系統共同組成(與選擇粒子流動管質譜儀SIFT-MS不同,SIFT-MS並不與濾質器直接連通)。質子轉移反應質譜儀通常使用四極桿質量選擇器或飛行時間質譜儀作為分析系統。商用的PTR-MS通常反應時間為100毫秒,並且可以達到兆分之一的靈敏度。PTR-MS的主要套用領域包括環境研究,食品與風味科學,生物研究,醫學研究等
工作原理:使用HO 作為離子源的質子轉移過程可以描述如下,其中 R指的是待測的痕量組分:
HO +R →RH +HO
上述反應受到質子間親和力的限制,僅可以在R的質子親和力比HO 大的情況下進行,即R的質子親和力需要大於691 KJ/mol。空氣中的主要成分例如氮氣N,氧氣O,氬氣Ar和二氧化碳CO等的質子親和力都要小於691 KJ/mol,因此可以認為HO 只和其中的揮發性有機物進行反應,而空氣本身則起到緩衝氣體的作用。此外,由於待測物中的痕量組分含量很低,通常可以近似認為反應過程中的HO 總數是維持不變的。由此,我們也就可以得到如下反應方程式:
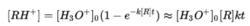 反應方程式
反應方程式其中,[RH ] 指的是反應物離子濃度,[HO ]指的是在默認緩衝氣體不參加反應的情況下的離子源離子濃度,k指的是化學反應速率常數,t指的是離子通過反應區域需要的平均時間。PTR-MS質譜儀可以對反應物離子濃度和離子源離子濃度進行測量,多數化合物的反應速率常數都可以在相關文獻中獲得,而反應時間通常可以從儀器參數中獲得。因此,痕量組分的絕對濃度[R]就可以很容易的通過計算獲得,而不需要進行任何校準或使用標準氣體。同樣這也說明了PTR-MS質譜儀的總靈敏度主要由離子源的離子產率決定。
