分類
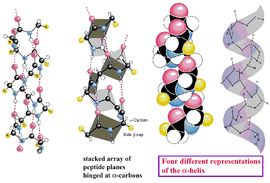
α-螺鏇(α-helix)
蛋白質中常見的一種二級結構,肽鏈主鏈繞假想的中心軸盤繞成螺鏇狀,一般都是右手螺鏇結構,螺鏇是靠鏈內氫鍵維持的。每個胺基酸殘基(第n個)的羰基氧與多肽鏈C端方向的第4個殘基(第n+4個)的醯胺氮形成氫鍵。在典型的右手α-螺鏇結構中,螺距為0.54nm,每一圈含有3.6個胺基酸殘基,每個殘基沿著螺鏇的長軸上升0.15nm。
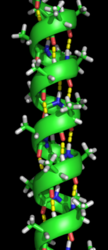 α-螺鏇 黃色部分為氫鍵
α-螺鏇 黃色部分為氫鍵螺鏇的半徑為0.23nm。
β-摺疊(β-sheet)
是蛋白質中的常見的二級結構,是由伸展的多肽鏈組成的。摺疊片的構象是通過一個肽鍵的羰基氧和位於同一個肽鏈或相鄰肽鏈的另一個醯胺氫之間形成的氫鍵維持的。氫鍵幾乎都垂直伸展的肽鏈,這些肽鏈可以是平行排列(走向都是由N到C方向);或者是反平行排列(肽鏈反向排列)。
β-轉角(β-turn)
多肽鏈中常見的二級結構,連線蛋白質分子中的二級結構(α-螺鏇和β-摺疊),使肽鏈走向改變的一種非重複多肽區,一般含有2~16個胺基酸殘基。含有5個胺基酸殘基以上的轉角又常稱之環(loops)。常見的轉角含有4個胺基酸殘基,有兩種類型。轉角I的特點是:第1個胺基酸殘基羰基氧與第4個殘基的醯胺氮之間形成氫鍵;轉角II的第3個殘基往往是甘氨酸。這兩種轉角中的第2個殘基大都是脯氨酸。
無規捲曲(randoncoil)
此種結構為多肽鏈中除以上幾種比較規則的構象外,其餘沒有確定規律性的那部分肽鏈的二級結構構象。
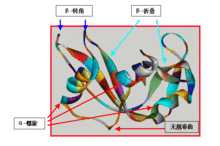 蛋白質的二級結構
蛋白質的二級結構