簡介
范特霍夫因子 i(英語: Van 't Hoff factor)(以荷蘭化學家范特霍夫命名)表示溶質對溶液依數性性質(如滲透壓、蒸汽壓下降、沸點升高和凝固點降低)影響的程度。范托夫因子是已溶解的物質產生的實際微粒濃度,和根據其質量所計算得出的濃度的比值,因而是無量綱的。
對於大多數溶解在水中的非電解質,范托夫因子數值是1。對於大多數溶於水中的離子化合物,范托夫因子等於該物質單位化學式(Formula unit)中所含獨立離子個數,如KCl是2,Ca(OH)是3;這僅在理想溶液中成立,因為離子締合(Ion-association)現象很少發生。在特定的瞬間,一小部分離子會配對在一起,因而被計為一個微粒。這種離子締合現象在任何電解質溶液中都會不同程度的發生,導致了與范托夫因子與實際間的偏差。這種偏差在離子有多重化合價(multiple charges,如銅、鐵)時會達到最大。
溶質解離
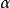 范特霍夫因子
范特霍夫因子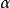 范特霍夫因子
范特霍夫因子溶質解離度是溶解於溶液中的溶質分子的比例。它通常用希臘字母阿爾法表示。這一係數和范托夫因子之間的關係很簡單;如果比例的溶質解離為了 n個離子,那么,
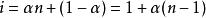 范特霍夫因子
范特霍夫因子例如,如下的電離方程,
KCl ⇌ K+ Cl
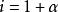 范特霍夫因子
范特霍夫因子產生了n=2個離子,所以。
溶質締合
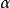 范特霍夫因子
范特霍夫因子類似的,如果n摩爾的溶質中以比例締合形成一個一摩爾微粒,那么
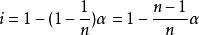 范特霍夫因子
范特霍夫因子例如,乙酸在苯中的二聚作用,
2CHCOOH ⇌ (CHCOOH)
兩摩爾的乙酸締合形成一摩爾物質,所以,
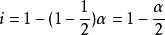 范特霍夫因子
范特霍夫因子物理意義
•若溶質微粒在溶液中締合, i值小於1,。例如各類羧酸或苯甲酸在苯中形成的二聚體,所以實際溶解的溶質微粒數是酸分子數的一半。
•若溶質分子在溶液中離解,i值大於1。例如氯化鈉、氯化鉀、氯化鎂等強電解質溶於水中。
•若溶質分子在溶解中既不離解也不締合,i值便等於1,例如葡萄糖溶於水中。
i值等於:i = 實際溶解的微粒數 ÷ 最初投入溶劑的微粒數。這表示平均算來,在稀溶液中,每單位化學式所溶解的微粒數。
范特霍夫方程
范特霍夫方程(Van 't Hoff equation)是一個用於計算在不同溫度下某反應的平衡常數的方程。設 K 為平衡常數, ΔH為焓變, ΔS為熵變, T為溫度。由雅各布斯·亨里克斯·范托夫提出。
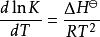 范特霍夫因子
范特霍夫因子或者寫為
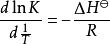 范特霍夫因子
范特霍夫因子如果假設反應焓變在不同溫度下保持恆定,則在不同溫度 T和 T下,等式的定積分為
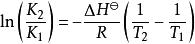 范特霍夫因子
范特霍夫因子這裡 K是在絕對溫度T下的平衡常數, K是在絕對溫度T下的平衡常數。 ΔH是標準焓變,R 是氣體常數。
參見
•依數性
•拉烏爾定律
•范托夫方程
•滲透壓
