簡介
在酸催化下,芳磺酸或其鹽與水共熱,磺酸基被氫原子取代,稱為脫磺酸基或脫磺酸基反應。例如:脫磺酸基是磺化的逆反應。該反應一般是在加壓下,於150~200℃,在稀鹽酸或稀硫酸溶液中進行。
在適當條件下,該反應的速度隨溫度而增加,通常每增高10℃,速度加快2.5~3.5倍。反應是在50~60% HSO(或淡鹽酸)及加熱條件下進行。本反應不同於水解,是由稀酸提供的質子引起:有機合成中主要用作“阻塞”作用。
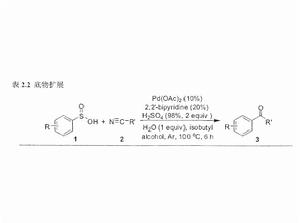
醋酸鈀催化的脫磺Heck反應
亞磺酸試劑的使用,主要是作為親核試劑參與反應。在過渡金屬催化下,斷裂碳硫鍵,釋放出二氧化硫,生成芳基或烷基的金屬試劑在有機合成中的套用並不多見。這樣就給過渡金屬催化脫磺反應帶來了機遇和挑戰。
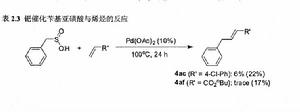
在傳統的Heck反應中,烷基的鹵代物作為底物參與反應的報導並不多見。因為這類底物一般含有β氫,在反應的過程中常常發生脫去β氫的反應,從而得不到與烯烴的交叉偶聯產物。因此實現烷基與烯烴的偶聯既是機遇又是挑戰。也嘗試了用苄基的亞磺酸與對氯苯乙烯或烯丙酸正丁酯進行反應,在我們的最佳條件下只得到了6%和trace量的交叉偶聯產物。隨後對反應條件進行了最佳化,發現在不加醋酸銅的條件下,加入20%的三環己基膦,反應24小時,產率有所提高,分別達到22%和17%。實現了烷基亞磺酸與烯烴的交叉偶聯。
 示例
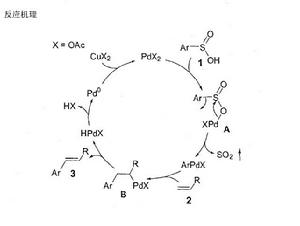
示例反應機理的研究
目前,儘管該反應的機理還不是很清楚,我們結合所得到的實驗結果和相關的文獻,提出了可能的反應途徑。首先,乙酸鈀與芳基亞磺酸發生陰離子的交換,生成苯亞磺酸鈀中間體A,在加熱的條件下,釋放出二氧化硫,同時生芳基鈀。然後,芳基鈀與體系中的烯烴發生順式加成,生成中間體B。最後經過B氫消除,生成交叉偶聯產物和零價鈀,在醋酸銅存在的條件下,醋酸銅將零價鈀氧化成具有催化活性的二價鈀,進行下一輪的催化循環。
 原理
原理