甲烷氯化物
| |
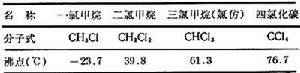
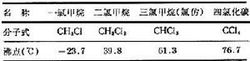
甲烷氯化物又名氯甲烷,甲烷分子中的氫原子被氯原子取代的產物,包括四種化合物(見表)。一氯甲烷為無色、有似醚臭味的氣體,其餘均為無色透明、易揮發的液體。
發展歷史
 甲烷氯化物
甲烷氯化物1847年弗雷澤用丙酮漂粉法首先小批量生產了麻醉用
氯仿。1893年繆勒和杜波依斯提出用二硫化碳液相氯化法生產四氯化碳。1923年德國赫斯特公司採用甲烷直接氯化法生產二氯甲烷。直到1937年,美國陶氏化學公司的裝置投產後,甲烷氯化工藝才被廣泛採用,成為生產氯甲烷的主要路線。一氯甲烷也可以由甲醇生產,此法到60年代末期已占有重要地位。
甲烷氯化物系列產品中,一氯甲烷作為甲基氯矽烷的原料,85%以上用於有機矽生產(基本上是自產自用),作為商品銷售的量很少;四氯化碳裝置在已開發國家按《關於消耗臭氧層物質的蒙特婁議定書》(以下簡稱“蒙約”)要求已被關閉(其二氯甲烷、三氯甲烷裝置副產的四氯化碳除極少部分銷往第三世界國家外,其餘的均作為生產原料轉化為其它產品予以消化);三氯甲烷大部分用作生產HCFC-22和聚四氟乙烯的原料,作為HCFC- 22的原料逐年在增長;二氯甲烷主要用於脫漆劑、粘合劑溶劑、農藥、氣溶膠等的生產。
目前世界甲烷氯化物供需基本平衡,但由於產品和國家地區之間的發展不平衡,其未來產量的增減也因地區而異。美國等發達工業國家和地區的消費將逐年減少。而世界的其他國家和地區,如東歐、亞洲和拉丁美洲等開發中國家對甲烷氯化物的市場需求量將會保持較快的增長速率。
我國屬開發中國家,除四氯化碳外,其他甲烷氯化物產品市場近幾年均處於高速生長期,目前已發展到一定規模。
《甲烷氯化物行業調研報告》對甲烷氯化物行業現狀、競爭格局、技術水平、上下游關聯、進出口、項目投資、相關政策法規等多方面多角度闡述甲烷氯化物行業狀況,並在此基礎上對未來市場格局和市場前景定性和定量的分析和預測。
生產方法
 甲烷氯化物的相關特性
甲烷氯化物的相關特性氯甲烷的生產方法基本可分為兩類:一類是通過甲烷氯化生產四種氯甲烷;另一類則是採用不同的原料專門生產四氯化碳或一氯甲烷。
氯甲烷製法
甲烷在光或熱的引發下與氯反應,其過程是:
CH4+Cl2─→CH3CL+HCl
CH3Cl+Cl2─→CH2Cl2+HCl
CH2Cl2+Cl2─→CHCl3+HCl
CHCl3+Cl2─→CCl4+HCl
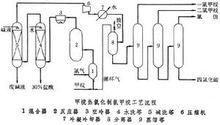
此過程得到的產品是上述四種氯化物的混合物,可通過精餾,分離為四種產物。適當調節甲烷與氯的分子比,可使四種氯化物分別達到很高的產率。但甲烷與氯的配比不能過小,因氯化是強放熱反應,配比愈小,生成高氯化物愈多,放出的熱量愈大。如不及時移走反應熱,當溫度高於500℃時,就會發生分解爆炸反應而生成炭。為了使氯化反應能順利進行,一般用大量過量甲烷在反應系統中循環,以烯釋原料氣,移走反應熱。如需多產高氯化物,則可將低氯化物作為循環氣返回反應器(見圖),以得到所需的氯化深度。
甲烷氯化物
一般將甲烷、氯、循環氣以2:1:9的體積比,在混合器中混合後,再進入反應器。在380~450℃、接近常壓下進行反應。反應混合物經冷卻、水洗(脫氯化氫)、鹼洗、乾燥、冷凝,然後送至分離器進行分離。不凝氣體除一部分當作尾氣經處理後放空外,其餘部分循環使用。冷凝液經精餾即得到各種氯代甲烷。甲烷氯化物的選擇性大於97%,氯轉化率大於99%。
一氯甲烷製法
可由甲醇在液相或氣相進行反應:
CH3OH+HCl─→CH3Cl+H2O
液相反應時,將甲醇蒸氣和氯化氫通入氯化鋅水溶液中,在100~150℃下進行反應生成氣態一氯甲烷,產物經水洗、冷卻、乾燥、壓縮冷凝等後處理即得產品。氣相反套用氧化鋁作催化劑(見固體酸催化劑),在300~350℃、0.3~0.6MPa下進行。後處理與液相法相同。該過程收率以甲醇計為92%~98%,以氯計為93%~95%。
四氯化碳製法
又分為二硫化碳氯化和有機氯化物氯解兩種方法。
①二硫化碳於30℃下,以鐵屑為催化劑可氯化製得四氯化碳:
2CS2+6Cl2─→2CCl4+2S2Cl2
2S2Cl2+CS2─→CCl4+6S
副產硫磺可循環送回二硫化碳生產車間。收率以二硫化碳計為90%~97%。該法的生產成本略高於其他方法,但由於不副產其他氯化烴和氯化氫,氯的利用率高,產品提純也較簡單,工業上仍有一定的套用。
②有機氯化物氯解制四氯化碳,原料是氯甲烷、氯乙烯、氯丙烯、氯苯以及氯醇法制環氧丙烷等生產中的精餾殘液。原料與氯氣在600℃和20MPa下進行氯解反應,可製得四氯化碳(選擇性可接近100%),同時也消除了含氯有機物的污染。
元素化合價
甲烷氯化物的結構幾乎相同,都是甲烷分子中的H原子被Cl原子取代所成。然而,在這四種甲烷氯化物以及甲烷本身中,碳元素的化合價卻有所差別。
首先說一下甲烷,其結構式為1個碳原子分別與4個氫原子以共價鍵(兩個或多個原子共同使用它們的外層電子,簡而言之就是共用電子對)的方式“相連”,因為C的電負性(兩個不同原子形成化學鍵時吸引電子能力的相對強弱,其數值越大,表示其原子在化合物中吸引電子的能力越強)為2.55,大於H的2.20,所以C—H鍵的共用電子對偏向C原子。因為每個電子帶一單位負電荷,故每個C—H鍵會給C原子提供1單位負電荷(共用電子對由二者分別提供1個電子組成,為了方便、通俗地說明,這裡採取了這種較不規範的說法),甲烷分子中共有4個C—H鍵,因此C原子共接受了4個共用電子對,也就是4單位負電荷。所以甲烷分子中的C顯-4價,H顯+1價。
一氯甲烷的是甲烷分子中的一個H原子被Cl2中的Cl原子取代所生成的。看起來其與甲烷分子結構相同,所以元素的化合價也應相同,其實不然,原因在於Cl的電負性為3.16,遠大於C的2.55,所以C—Cl鍵中,共用電子對反而偏向Cl原子,因此會給C原子提供1正電荷(相反地,給Cl原子提供1單位負電荷)。其餘三個C—H鍵分別給C原子提供1單位負電荷,這樣C原子共有(3-1=)2單位負電荷。因此一氯甲烷分子中,C顯-2價,H顯+1價,Cl顯-1價。
二氯甲烷中,2個C—Cl鍵帶給C原子的正電荷恰好被2個C—H鍵帶來的負電荷抵消。故在二氯甲烷分子中,C顯0價,H顯+1價,Cl顯-1價。
三氯甲烷則是有3個C—Cl鍵,1個C—H鍵,所以C原子共有2個正電荷。所以在三氯甲烷分子中,C顯+2價,H顯+1價,Cl顯-1價。
四氯甲烷(CCl4)是CH4中的H原子全部被Cl2中的Cl原子取代而成,四個鍵均為C—Cl鍵。因此在四氯甲烷分子中,C顯+4價,Cl顯-1價。
綜上所述,在甲烷及其氯化物中,H均顯+1價,Cl均顯-1價,而C存在-4、-2、0、+2、4的變價,不能因為結構相似就混為一談。
用途
所有氯甲烷都廣泛用作溶劑,它們的溶解性強,且具有不燃(除CHCl外)的優點;其缺點是均有毒,使用時須採取特殊措施。一氯甲烷可用作低溫聚合生產丁基橡膠的低溫溶劑。二氯甲烷常用作塗料、電影膠片、醋酸纖維、碳酸酯等生產中的溶劑,也用於金屬脫脂。三氯甲烷則是青黴素、維生素、油脂及生物鹼等的萃取劑。此外,它們還作為中間體或反應組分套用於各個領域,其重要性正在日益增大。例如:一氯甲烷是生產甲基纖維素、甲基氯矽烷、甲基鉛的原料和某些農藥的甲基化試劑,三氯甲烷和四氯化碳主要用於製造氟利昂。純淨的氯仿,過去作為麻醉劑使用,但因有毒現已不用。四氯化碳也可作為滅火劑,這是因為它不僅不會燃燒,沸點低,遇熱易變為氣體,而且比空氣重,能使燃燒物與空氣隔絕而熄滅。氯仿遇空氣或日光分解為光氣,故通常貯存時,加入1%乙醇作穩定劑。
相關連線
氯化物
甲烷
烷烴
有機物