物性數據
1、密度(g/mL,20/4℃):0.85g/mL
2、相對蒸汽密度(g/mL,空氣=1):3
3、沸點(ºC,常壓):35℃
4、閃點(ºF):5°F
5、溶解性:不溶於烴類溶劑;能適當溶於醚類溶劑;與水和其它質子性溶劑反應生成甲烷 。
計算化學數據
1、疏水參數計算參考值(XlogP):無
2、氫鍵供體數量:0
3、氫鍵受體數量:1
4、可旋轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積:0
7、重原子數量:2
8、表面電荷:0
9、複雜度:2
10、同位素原子數量:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
13、確定化學鍵立構中心數量:0
14、不確定化學鍵立構中心數量:0
15、共價鍵單元數量:2
性質與穩定性
1、常溫常壓下穩定,避免氧化物、酸、水分接觸。
2、非溶劑化的固體易自燃;在沒有LiBr的情況下,乙醚中的甲基鋰容易自燃;而其它常見的配方(無論液體或者固體)都不會自燃。
生態學數據
對水是稍微有害的,不要讓未稀釋或大量的產品接觸地下水,水道或者污水系統,若無政府許可,勿將材料排入周圍環境。
貯存方法
密封保存在低溫、乾燥並且有惰性氣體保護的容器中 。
合成方法
在一個裝有磁力攪拌器、氣體導入管和乾冰冷凝管的三頸瓶中,放入800毫升無水乙醚和托克(2.3克原子)銼絲,在連續攪拌下4-5小時內向反應瓶內蒸入100克(1.05摩爾)溴甲烷,然後將此混合物攪拌1小時。在氮氣流中放置過夜以使不溶物沉澱,在氮氣中將上層清液轉移到乾燥的有橡皮蓋的貯液管或容器中。
反應方程式為:CHBr+2Li=CHLi+LiBr。
主要用途
甲基鋰可以對多種官能團進行甲基化,可以脫除保護基團,合成其它甲基化有機金屬試劑,可以作為鹼以及還原過渡金屬等。溶劑和鹵素對用到非溶劑化的甲基鋰的反應有很大的影響 。
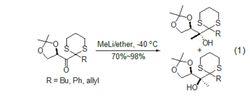
1、加成反應:與甲基格氏試劑相比,甲基鋰與環烴、雜環以及脂肪族化合物的1,2-加成反應有不同的選擇性。與酮的親核加成由於螯合反應而有高的非對映選擇性 (式1)。另外,這個反應的立體選擇性也受其它一些Lewis酸的影響。
 甲基鋰
甲基鋰2、把有機鋰轉化為有機鈦、有機鈰或者有機鋅後會提高其立體選擇性。例如,將甲基鋰轉化為手性鈦與苯甲醛發生1,2-加成,產物ee值達到99% (式2)。
 甲基鋰
甲基鋰3、用酸和酯作用經常會得到甲基酮,而用三甲基氯矽烷處理這個反應將會得到更好的結果。對於用烷氧羰基和苯甲醯基保護的二級醯肼來說,甲基鋰是一個很好的脫醯基試劑。將甲基鋰與溴化鋰共同與甲矽烷基酮在0℃作用,會高立體選擇性地得到甲矽烷基烯醇醚 (式3)。
 甲基鋰
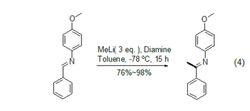
甲基鋰4、腈、亞胺以及唑烷都可以作為碳氮不飽和鍵的1,2-加成的底物。例如,在異丙基苯/THF中,甲基鋰與保護的氰醇加成,水解後得到很高產率的甲基甾族酮[7]。而四嗪、吡嗪等芳香雜環的加成反應就很難進行。芳香亞胺可以在具有C2對稱性的三級二胺的催化下,與甲基鋰發生對映選擇性的加成 (式4)。
 甲基鋰
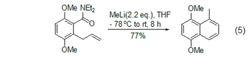
甲基鋰5、甲基鋰可以與鄰烯丙基苯甲醯胺成環生成萘酚衍生物 (式5)。
 甲基鋰
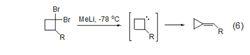
甲基鋰6、甲基鋰使環丙基衍生物的偕二溴化物發生重排得到丙二烯衍生物和一溴取代物的混合物。甲基鋰還可以與偕二溴代環丁烷作用,脫除溴重排得到亞烷基環丙烷 (式6)。
 甲基鋰
甲基鋰