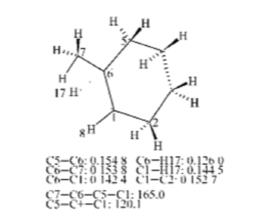
常用方法
1、法伏爾斯基重排
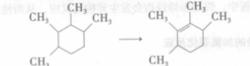
α一鹵代脂環酮在鹼催化劑(CHONa,NaOH等)存在下起環縮小重排反應,生成酯或酸。
例如:
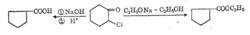 環縮小重排反應
環縮小重排反應反應歷程有兩種不同說法,反應產物因反應條件而異:
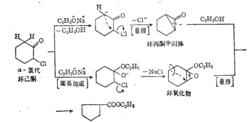 反應歷程
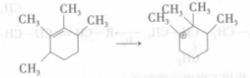
反應歷程2、傑米亞諾夫重排
氨基直接在環上的脂環族伯胺和亞硝酸作用時發生重氮化、脫氮及環縮小重排反應。
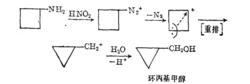 反應方程式
反應方程式環烷烴環縮小反應
環烷烴在加氫裂化催化劑上的反應主要是脫烷基反應、六員環的異構和開環反應以及“剝皮”反應。帶長側鏈的單環環烷烴主要是發生斷鏈反應。與烷烴正碳離子相比,環烷烴正碳離子的最大特點是難以裂解,只有在苛刻條件下,環烷烴正碳離子才發生β一位斷裂反應。
“剝皮”反應,是指C~C的烷基環己烷以高選擇性的方式進行加氫裂化,烷基側鏈被脫除(“剝皮”),其主要產物是i—C和比反應物少4個碳原子的環烷烴,烷烴的異正構比高,並發生環縮小反應。
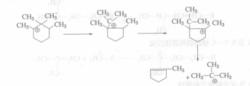
環烷烴反應的歷程如下:
1、環烷烴在金屬催化劑作用下脫氫形成烯烴
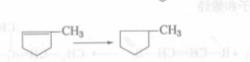
 步驟一
步驟一2、烯烴在酸性中心作用下形成碳正離子
 步驟二
步驟二3、發生C—C鍵斷裂的裂化反應和異構化反應
 步驟三
步驟三4、加氫飽和反應
 步驟四
步驟四戊腈衍生物環縮小反應
研究背景
戊腈衍生物縮環反應制鹵代吡啶的方法自80年代後得到廣泛套用,但關於此類反應的機理尚未見文獻報導。1985 年,Pews和 Lysenko採用縮環反應製得了多種鹵代吡啶,其中,在合成 2,3-二溴-5-甲基吡啶時,他們採用以下方法:
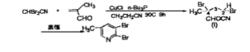 反應方程式
反應方程式經過多次反覆實驗,都觀察到類似的結果,即 2,2-二溴-乙腈的轉化率約為 40%,2,3 -二溴-5-甲基的產率也為40%。他們認為化合物1中4位直的Br熱力學不穩定,因此在較高的溫度下就可以快速脫去HBr,而生成的HBr則可繼續催化縮環反應。
環化過程如下:
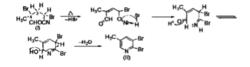 環化過程
環化過程反應機理
1、機理一
第一步,戊腈類衍生物脫去一分子 HX,形成雙鍵。
第二步,帶著一對孤對電子進攻HX 中的 H而X 則帶著與H 成鍵的電子進攻與N 相連的C 形成 C=N 雙鍵。
第三步,因羰基碳帶正電性,N 帶著一對未成對電子進攻羰基碳,從而閉合成環。而氧則帶雙鍵的一對電 子進攻H+,形成羥基.。
第四步,已形成的六元環,脫水,雙鍵重排,成為吡啶環。
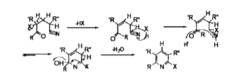 反應機理一
反應機理一2、機理二
第一步,H 進攻羰基氧,氧上帶正電荷,增加了羰基碳上的正電性。
第二步,N 帶著叄鍵上一對電子進攻羰基碳,形成閉合六元環. 碳氧雙鍵斷裂成單鍵。
第三步。X 帶著一對電子進攻正電性的碳。
第四步,六元環脫去一分子HX ,形成雙鍵。
第五步,雙鍵重排,形成仲胺。
第六步,脫去一分子水,形成吡啶環。
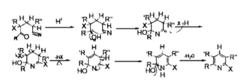 反應機理二
反應機理二