基本內容
狄爾斯–阿爾德反應是一種有機反應,共軛雙烯與取代烯烴(一般稱為親雙烯體)反應生成取代環己烯。該反套用很少能量就可以合成六元環,是有機化學合成反應中非常重要的碳碳鍵形成的手段之一,也是現代有機合成里常用的反應之一。反應有豐富的立體化學呈現,兼有立體選擇性、立體專一性和區域選擇性等。該反應是可逆反應,正向成環的反應溫度較低,逆向開環反應需要較高的溫度。
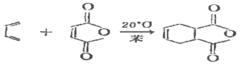 狄爾斯-阿爾得反應
狄爾斯-阿爾得反應由反應式可知,此反應分為兩部分, 即一部分為提供共軛雙烯化合物—雙烯體,另一部分為提供不飽和鍵的化合物 —親雙烯體。
雙烯烴的種類
(1) 開鏈順式共軛雙烯類:如順1,3-丁二烯及其衍生物等
(2) 環內雙烯類:如環戊二烯及其衍生物
(3) 跨環雙烯類。
親雙烯體的種類
(1)雙鍵類親雙烯體:如-C=C-Z 或Z-C=C-Z′(Z 或Z′CHO,COR,COH,COR,COCl,COAr,CN,NO,Ar,CHOH,CHCl,CHNH, CHCN,CHCOH,X 或C=C)
(2) 叄鍵類親雙烯體:如-C≡C-Z或Z-C≡C-Z((Z 或Z′同上)
(3)含其它原子的雜親二烯體:如-CN,-C=N-,-N=N-,O=N 及-C=O 等。
催化劑
狄爾斯–阿爾德反應基本上是自發進行的, 一般不用催化劑, 但在室溫或低溫下,反應難於進行,可適當加些催化劑以加速反應 的進行。所用的催化劑一般為路易斯酸,如AlCl,BF,SnCl 和TiCl 等。
發展過程
最早的關於狄爾斯–阿爾德反應的研究可以上溯到1892年。齊克(Zinke)發現並提出了狄爾斯-阿爾德反應產物四氯環戊二烯酮二聚體的結構;稍後列別捷夫(Lebedev)指出了乙烯基環己烯是丁二烯二聚體的轉化關係。但這兩人都沒有認識到這些事實背後更深層次的東西。
1906年
德國慕尼黑大學研究生阿爾布萊希特(Albrecht)按導師惕勒的要求做環戊二烯與酮類在鹼催化下縮合,合成一種染料的實驗。當時他們試圖用苯醌替代其他酮做實驗,但是苯醌在鹼性條件下很容易分解。實驗沒有成功。阿爾布萊希特發現不加鹼反應也能進行,但是得到了一個沒有顏色的化合物。阿爾布萊希特提了一個錯誤的結構解釋實驗結果。
1920年
德國人馮·歐拉(von Euler)和學生約瑟夫(Joseph)研究異戊二烯與苯醌反應產物的結構。他們正確地提出了狄爾斯–阿爾德產物結構,也提出了反應可能經歷的機理。事實上他們離狄爾斯–阿爾德反應的發現已經非常近了。但馮·歐拉並沒有深入研究下去,因為他的主業是生物化學(後因研究發酵而獲諾貝爾獎),對狄爾斯–阿爾德反應的研究純屬娛樂消遣性質的,所以狄爾斯-阿德爾反應再次沉沒下去。
正式發現
狄爾斯和其研究生巴克(Back)研究偶氮二羧酸二乙酯(半個世紀後因光延反應而在有機合成中大放光芒的試劑)與胺發生的酯變胺的反應,當他們用2-萘胺做反應的時候,根據元素分析,得到的產物是一個加成物而不是期待的取代物。狄爾斯敏銳地意識到這個反應與十幾年前阿爾布萊希特做過的古怪反應的共同之處。這使他開始以為產物是類似阿爾布萊希特提出的雙鍵加成產物。狄爾斯很自然地仿造阿爾布萊希特用環戊二烯替代萘胺與偶氮二羧酸乙酯作用,結果又得到第三種加成物。通過計量加氫實驗,狄爾斯發現加成物中只含有一個雙鍵。如果產物的結構是如阿爾布萊希特提出的,那么勢必要有兩個雙鍵才對。這個現象深深地吸引了狄爾斯,他與另一個研究生阿爾德一起提出了正確的雙烯加成物的結構。1928年他們將結果發表,這標誌著狄爾斯-阿德爾反應的正式發現。
1950年
伍德沃德第一個開創了狄爾斯–阿爾德反應在全合成中的套用。從此以後,合成大師們用睿智的大腦把狄爾斯–阿爾德反應的套用發揮到了爐火純青的極致。值得指出的是,在伍德沃德之前,中國化學家莊長恭曾經嘗試過用狄爾斯–阿爾德反應來合成甾體化合物,但是由於當時缺乏對狄爾斯–阿爾德反應區域選擇性的控制的知識而失敗了。
反應機理
狄爾斯–阿爾德反應是典型的[4+2] 型的環加成反應,其反應機理一般認為,在反應時兩反應物彼此靠近,相互作用, 形成一個環狀過濾態。然後逐漸轉化為產物分子,即舊鍵的斷裂與新鍵的形成是相互協調地在同一步驟中完成的—協同反應,無中間體生成。反應圖如下所示:
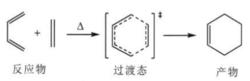 狄爾斯-阿爾得反應
狄爾斯-阿爾得反應證明,1,3-丁二烯和乙烯的反應是一個簡單而典型的軌道控制Diels-Alder 反應,最初用前線軌道原理, 見下圖,這是舊鍵斷裂同時新鍵形成的協同反應,最初是由對稱性匹配來解釋 Diels-Alder 反應。
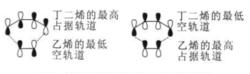 前線軌道理論對D-A反應的解釋
前線軌道理論對D-A反應的解釋立體化學
1、區域選擇性:反應產物往往以假鄰對位產物為主。即若把六元環產物比作苯環,那么環上官能團(假設有兩個官能團)之間的相互位置以鄰位(如1),或者對位為主(如3)
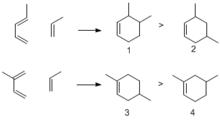 狄爾斯-阿爾得反應
狄爾斯-阿爾得反應2、立體選擇性:反應產物以內型(即5)為主,即反應主產物是經過內型過渡態得到的。
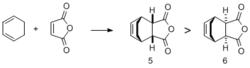 狄爾斯-阿爾得反應
狄爾斯-阿爾得反應3、立體專一性:加熱條件下反應產物以順旋產物為唯一產物,光照條件下以對旋產物為唯一產物。
套用擴展
由於該反應一次生成兩個碳碳鍵和最多四個相鄰的手性中心,所以在合成中很受重視。如果一個合成設計上使用了狄爾斯–阿爾德反應,則可以大大減少反應步驟,提高了合成的效率。狄爾斯-阿爾得反應在有機合成中有重要用途,是合成六元環狀化合物的重要方法。把反應中的碳原子換成雜原子,也能進行類似的反應,得到含雜原子的六元環化合物。
氮雜雙烯
用亞胺與雙烯合成四氫吡啶類物質的環加成反應。這種有機化學反應是狄爾斯–阿爾德反應的變種,氮原子取代了原反應中雙烯或雙烯親和物中亞甲基或次甲基。此反應反應物中的亞胺往往是由胺和甲醛在原位產生的,比如環戊二烯與苯甲胺生成氮雜降冰片烯的反應,反應過程如下圖所示:
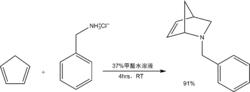 氮雜降冰片烯合成反應
氮雜降冰片烯合成反應路易斯酸催化
科里對狄爾斯–阿爾德反應也有很大的貢獻,發明了一種路易斯酸催化的不對稱狄爾斯–阿爾德反應。在其合成前列腺素過程中,科里試圖利用環戊二烯做狄爾斯–阿爾德反應來構筑前列腺素的母環,由此發明了不穩定烯酮的替代試劑。丹尼謝夫斯基則以發明十分有用的“丹尼謝夫斯基雙烯”用於狄爾斯–阿爾德反應而最為出名,在其全合成實踐中狄爾斯–阿爾德反應也隨處可見。
 狄爾斯-阿爾得反應
狄爾斯-阿爾得反應