無電解鍍鎳也叫做化學鍍鎳(以下統稱化學鍍鎳),是在含有特定金屬鹽和還原劑的溶液中進行自催化反應,析出金屬並在基材表面沉積形成表面金屬鍍層的一種優良的成膜技術。
化學鍍鎳工藝簡便,成本低廉,鍍層厚度均勻,可大面積塗覆,鍍層可焊姓良好,若配合適當的前處理工藝,可以在高強鋁合金和超細晶鋁合金等材料上獲得性能良好的鍍層,因此在表面工程和精細加工領域得到了廣泛套用。
一、化學鍍鎳工藝
化學鍍鎳工藝流程為:試樣打磨-清洗-封孔-布輪拋光-化學除油-水洗-硝酸除銹-水洗-活化-化學鍍-水洗-鈍化-水洗-熱水封閉-吹乾。
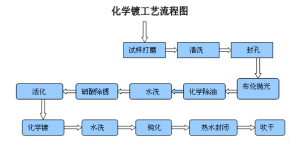 化學鍍鎳的工藝流程圖
化學鍍鎳的工藝流程圖 二、化學鍍鎳分類
化學鍍鎳的分類方法種類多種多樣,採用不同的分類規則就有不同的分類法。
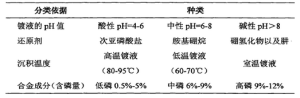 化學鍍鎳分類
化學鍍鎳分類 三、化學鍍鎳原理
目前以次亞磷酸鹽為還原劑的化學鍍鎳的自催化沉積反應,已經提出的理論有羥基-鎳離子配位理論、氫化物理論、電化學理論和原子氫態理論等,其中以原子氫態理論得到最為廣泛的認同。
該理論認為還原鎳的物質實質上就是原子氫。在以次亞磷酸鹽為還原劑還原Ni2+時,可以以下式子表示其總反應:
3NaH2PO2+3H2O+NiSO4→3NaH2PO3+H2SO4+2H2+Ni(1)
也可表達為:
Ni2++H2PO2-+H2O→H2PO3-+2H++Ni(2)
其過程可分為以下四步:首先,加熱化學沉積鎳-磷合金鍍液,此時鍍液並未馬上反應,而是金屬首先進行催化,H2PO2-在水溶液中發生脫氧生成了H2PO3-,同時釋放出原子態活性氫。
H2PO2-+H2O→H2PO3-+2H吸附+H+(3)
然後,原子態活性氧被吸附在催化金屬表面上而使其活化,把水溶液中的Ni2+還原生成的金屬鎳同時在催化金屬表面上進行沉積。
Ni2++2H吸附→2H++Ni(4)
再後,在催化金屬表面上的原子態活性復與H2PO2-反應將其還原為P。與此同時,因為金屬的催化作用使次H2PO2-發生了分解,生成了亞磷酸根,並脫附析出氧氣分子。
H2PO2-+H→P+H2O+OH-(5)
H2PO2-+H2O→H2PO3-+H2(6)
2H→H2↑(7)
最後,鎳原子和磷原子共沉積,並形成鎳-磷合金層。
P+3Ni→Ni3P(8)
以上反應全部都需要在較高的溫度(一般為60<95℃)下提供能量,並在催化活性表面上進行。反應除了生成金屬Ni之外,還還生成了P、H2PO3-和H2,反應過程中生成的H+使鍍液pH下降,酸性更強。反應速率與鍍液成分、pH和溫度以及其他因素都有關係。
從方程(4)(5)(8)可以發現,反應生成的鎳與磷結合生成鍍層合金。所以實際上若還原劑使用次亞磷酸鹽則反應形成的鍍層是鎳-磷合金,其含磷量約在3-15%之間。
同時可以看到(2)(5)(6)反應過程相互競爭:
Ni2++H2PO2-+H2O→H2PO3-+2H++Ni(2)
H2PO2-+H→P+H2O+OH-(5)
H2PO2-+H2O→H2PO3-+H2(6)
(2)(5)(6)反應過程表明,若在溫度不變,鍍液pH值升高,則有利於反應式(2)的進行,即會提高鎳的還原速度,同時磷的還原速度反而會下降,因而此時得到了磷含量下降的鍍層;反之,降低鍍液pH值,對反應(5)、(6)兩過程的進行非常有利,此時鎳離子被還原的速度會下降,磷被還原的速度會進一步提高,H2的析出量也升高。
四、化學鍍鎳液的組成
鍍液的組成包括主鹽(鎳鹽),絡合劑、緩衝劑、加速劑、還原劑、穩定劑、濕潤劑、光亮劑、去應力劑、pH調整劑等。
1)主鹽(鎳鹽)
主鹽即含鍍層金屬離子的鹽,鎳鹽是化學鍍鎳溶液中的主鹽,主要有Ni2SO4、NiCl2、醋酸鎳、磺酸鎳等,其主要作用是提供Ni2+。目前套用最多的就是硫酸鎳。由化學反應速率影響因素可知,主鹽濃度越小時沉積速率就越慢,生產效率就越低,反之,主鹽含量越高時沉積速率越快,生產效率越高,但主鹽濃度過大時會導致反應速度過快,就容易使表面沉積的金屬鍍層比較粗糙,而且鍍液穩定性降低,容易發生自分解現象,降低鍍液穩定性。
2)還原劑
還原劑是提供電子以還原主鹽離子的試劑。主要有NaH2PO2、NaBH4、二甲基氨硼烷、肼、二乙基氨硼烷等。
鍍液還原劑若使用NaBH4、氨基硼烷等硼化物時可得Ni-B合金;若採用N2H4作還原劑,獲得的金屬鍍層的純度相對較高。在酸性鍍鎳液中採用的還原劑常採用NaH2PO2,此時得到的鍍層為Ni-P合金。NaH2PO2的優點是採購價格便宜、易溶於水、鍍液較易控制、鍍層性能優良等。一般情況下,NaH2PO2使用量與主鹽量的關係為:
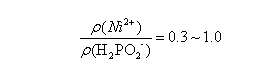 NaH2PO2使用量與主鹽量的關係
NaH2PO2使用量與主鹽量的關係 溶液中的主鹽和還原劑的反應速度受還原劑濃度的影響很大,還原劑濃度越大,其還原能力越強,反應速度就會加快;但是還原劑濃度過高則導致溶液發生自分解反應,工藝控制難度加大,獲得的金屬沉積鍍層的外觀也難以達到理想要求。
3)絡合劑
絡合劑具有重要的作用,在化學鍍鎳工藝中的地位僅次於主鹽和還原劑。如果化學鍍鎳鍍液中未添加絡合劑,因為鎳的氧氧化物的溶解度比較小,當鍍液為酸性溶液時,發生水解非常容易生成淺綠色絮狀的含水氧氧化鎳沉澱所以常在鍍液中添加絡合劑。
化學鍍鎳鍍液常用的絡合劑有:檸檬酸、蘋果酸、丙二酸、丁二酸、琥珀酸、羥基乙酸、氨基乙酸、乳酸、酒石酸、EDTA(乙二胺四乙酸)、HEDP(羥基乙叉二膦酸)、ATMP(氨基三甲叉膦酸)、乙二醇酸。
絡合劑的主要作用是:絡合劑能夠與金屬離子發生絡合反應,生成絡合物,從而降低了游離態的金屬離子的濃度,能夠減少金屬離子的水解反應而防止鍍液因而產生的自然分解,使鍍液的穩定性增強。當然,絡合劑濃度也不能太高,因為其濃度過高容易導致游離態的金屬離子濃度過低,使反應變慢進而導致金屬沉積速率變慢,所以選擇合適的絡合劑用量也非常關鍵。不同絡合劑在施鍍過程中會對施鍍反應有一定影響,無論是反應速率還是鍍層組成及特徵。有時為了得到性能優良的鍍層同時保持合適的反應沉積速率,常常將多種絡合劑複合使用以期取長補短、相輔相成,從而取得更好的綜合效果。
另外,焦磷酸鹽、檸檬酸鹽和銨鹽等可在鹼性化學鍍鎳溶液使用,比如使用檸檬酸鈉和氯化銨做絡合劑時,以鎳鹽總量的1.5倍添加較好。
4)穩定劑
穩定劑其作用是升高鍍液的穩定性。其原理是在固體微粒表面有一些催化點,在這些催化點上會有穩定劑的離子進行吸附,從而防止或者減少了鎳離子的還原。化學鍍鎳鍍液屬於熱力學不穩定體系,在施鍍過程中鍍液容易受到污染,還可能局部過熱、pH值變化、存在有催化活性的固體顆粒等異常情況的影響而導致鍍液失效。因為穩定劑同時也是毒化劑,所以加入量不能過大,否則將會因為中毒而使鍍液失去活性,鍍速降低甚至導致施鍍失敗,因此只需少量添加即可。
化學鍍鎳的穩定劑主要有四類:①重金屬離子如鉛、鉍、鋅、鎘、錫、銻、鉈、等;②含氧酸鹽,如鉬酸鹽、碘酸鹽;③含硫化合物,如硫脲、異硫脲、四氮唑丙烷磺酸鹽、羥基苯並噻唑、黃原酸酯、硫代硫酸鹽、硫代鄰苯二甲酸酐等;④有機酸衍生物,如甲基四羥鄰苯二甲酸酐、六氯內亞甲醛四羥鄰苯二甲酸酐等。穩定劑除了能使鍍液穩定外有的還有光亮作用加速作用和提高鍍層耐蝕性等作用。要特別注意,即使穩定劑的使用量是微量的,也會影響鍍層的各項性質,若使用不合理容易導致鍍層出現缺陷(如疏鬆、小孔、耐蝕性差等),所以其選擇和使用必須慎重。一般用Pd2+作為酸性化學鍍鎳溶液的穩定劑時,其使用量只有數毫克/升,而在鹼性鍍液中它的使用量反而相對較大。
5)緩衝劑
緩衝劑是由一些弱酸(或弱鹼)和它們對應的鹽混合而成,其溶液能夠抵抗少量外來的強鹼(或強酸)或者適當的稀釋而保持pH值幾乎不變,那么這些弱酸(或弱鹼)和它們對應的鹽就叫做緩衝劑。
在酸性化學鍍鎳液中最有效的緩衝劑是有機一元和二元酸的鉀鹽和鈉鹽,因為較高相對分子質量的酸會形成不溶性的鎳鹽,最常用的一元酸是醋酸和丙酸或它們的鹽類,二元酸(如丙二酸和丁二酸)是更有效的緩衝劑,但丙二酸價格貴不適於工業套用,有些配方既含有一元酸也含有二元酸。此外硼酸也是有效的緩衝劑。
6)促進劑
促進劑是指加入鍍液中能顯著提高沉積速度的物質,在加入強配位劑的鍍液中Ni2+離子受到強的配位,其還原速度受到抑制,在這種鍍液中加入第二種配位劑以減弱鎳酸離子的配位狀態或改變鎳配離子的結構,就可達到加快沉積速度的目的。其中丙酸、丁二酸、氨基乙酸、氟化物、硼酸鹽等都是常用的促進劑。
7)表面活性劑
在鍍液中表面活性劑也被稱作濕潤劑,其主要作用是提高鍍件表面的浸潤性,有利於使氣體逸出,改善鍍層的孔隙率,常採用陰離子或非離子表面活性劑。
一般情況下,表面活性劑的添加較適宜的數量為鍍液總質量的0.1%-0.15%。目前化學鍍鎳工藝中常採用烷基苯磺酸鈉、烷基磺酸鈉和十二烷基脂肪酸鈉等,它們都屬於陰離子型表面活性劑;非離子表面活性劑有6501淨洗劑、TX-9和TX-10等。
8)光亮劑
光亮劑的作用是增強化學鎳層的光亮度,使鍍件具有一定裝飾效果。化學鍍鎳層剛鍍出時通常就是半光亮的,可以添加一些光亮劑來提高鍍層的光亮度,如萘二磺酸鈉、對甲苯磺醯胺、硫脲等。在酸性化學鍍鎳液中均能產生光亮沉積層,硒酸、鎘離子、碲和鉛離子也都是有效的光亮劑,而且這些物質的加入量也有像有機化合物那樣嚴格。
除此之外,化學鍍鎳鍍液有時還可添加適量的應力劑(降低鍍層的內應力,提高鍍層與基體的結合力)和pH值調整劑(如H2SO4、HCl、NaOH、氨水等),以提高施鍍效果。
