簡介
烯丙型的有機物在有機反應中很常見,並且運用廣泛,相關文獻已經報導了關於烯丙型參與的反應,例如金屬有機化學中鈀催化的烯丙基偶聯反應,能將烯丙基官能團高效地引入相應的底物中。另外丙烯的α-氫的氯代反應(如右圖所示的部分機理)就是典型的烯丙型反應,高溫下氯氣均裂氯自由基,然後將丙烯的α氫原子取代最終生成3-氯丙烯。我們可以簡單地將烯丙型解釋為在一定條件下可以產生烯丙基自由基或者烯丙基正離子。這兩個中間體的穩定性都是比較好的,能介導後續地有機反應,是高活性的中間體。
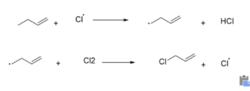 3-氯丙烯的自由基反應
3-氯丙烯的自由基反應烯丙基正離子介紹
烯丙基碳正離子,有機化學反應中的重要的活潑中間體,是碳正離子的一種。C-C雙鍵的α位碳失去一個電子,帶部分正電荷,碳原子上的p軌道和C-C雙鍵的π鍵形成p-π共軛效應,且分子呈平面結構,C-C雙鍵上的電子云離域分散,增加了穩定性。對於反應中間體來說,穩定性越高,越容易生成。相應的過渡態也容易形成,反應性越高。
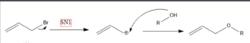 烯丙型參與的親核取代反應
烯丙型參與的親核取代反應碳正離子的穩定性順序為烯丙基正離子≈苄基正離子>叔碳正離子>仲碳正離子>伯碳正離子。碳正離子的穩定性可以通過實驗測定,例如測定它的生成熱,比較生成熱的大小,可以知道他們相對的穩定性。另外利用碳正離子易與親核試劑反應,如果親核試劑是水,可以通過平衡常數來比較碳正離子的穩定性。
烯丙基正離子一般在SN1親核取代反應中產生,烯丙位的碳上連線有離去基團(Br),在酸性條件下離去,烯丙位碳失去一對電子,形成烯丙基碳正離子;進而親核試劑(R-OH)進攻烯丙位的碳,生成取代產物。
烯丙基自由基介紹
丙烯分子中甲基(CH3—)碳原子上發生均裂後去掉一個氫原子,剩下的一價基團,結構式為:H2C=CH—CH2—。—CH=CH-CH3 叫正丙烯基(系統命名叫1-丙烯基), —CH2-CH=CH2叫正烯丙基(系統命名叫2-丙烯基)。烯丙基是給電子基團,而丙烯基是吸電子基團。烯丙基碳的最外層電子數是7,和烯丙基碳正離子一樣發生p-π共軛作用,使得電子云分散,穩定性比一般的自由基高,其自由基穩定性的順序也和烯丙基碳正離子一致。
一個適於在實驗室條件下進行烯烴的α氫鹵化的常用方法是用 N-溴代丁二醯亞胺(NBS)為溴化劑,在光或者引發劑如過氧化苯甲醯作用下,在惰性溶劑如四氯化碳中與烯烴作用生成α-溴代烯烴。NBS在四氯化碳中不溶,真正的反應實在NBS固體表面上發生,反應中生成的溴化氫不斷地與NBS反應產生溴,使反應能繼續進行,直到NBS用完,反應完成。實際上,NB猶如一個溴的儲存庫,只要反應中生成一點溴化氫,它即可與NBS反應產生一點溴,所以在反應體系中始終使溴保持在低濃度,這和上述在高溫下丙烯的鹵化一樣,有利於α氫的取代。