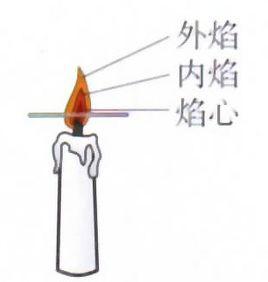
簡介
火焰溫度是火焰的主要特性之一。它對火焰中化合物的形成和解離,從而對待測元素的原子化有著重大的影響。
在火焰中,一方面由於燃燒反應要產生熱量,另一方面由於火焰中化合物的解離,以及為了將火焰中存在的平衡混合物提高到火焰溫度需要消耗熱量,火焰的溫度就是由火焰中這二者之間的熱量平衡來決定的。當火焰處於熱平衡狀態時,溫度就可用來表征火焰的真實能量。
測定方式
火焰溫度,可用實驗方法測定。測量火焰溫度的方法總的可分為兩大類,即測溫測量法和光學測量法。測溫測量法是要引入一個測溫體,比如引入一根金屬絲或熱電偶到火焰內欲測量的區域,當測溫體和火焰熱氣體的溫度達到平衡之後,由測溫體金屬絲的電阻變化或熱電偶接點上產生的熱電壓來測量溫度。由於熱導和輻射損失,用這種方法測得的溫度較實際火焰溫度偏低,而且這種方法只適用於熱平衡的場合。由於受到測溫體熔點的限制,用這種方法所能測量的最高溫度也就是在3000℃左右。
光學測量法中,最常用的是鈉線自蝕法。該法是先將鈉鹽引入火焰,用看譜鏡對著發亮的背景連續光源進行觀測,當連續光源比火焰溫度高,則鈉D線以吸收黑線出現在背景上,反之,當連續光源比火焰溫度低時,則鈉D線以亮線出現在背景上,當連續光源和火焰溫度相同時,達到自蝕點。自蝕點的溫度可用記錄連續光源標準鎢絲燈的燈電流的方法來確定。標準鎢絲燈光源用光學高溫計校準。用標準鎢絲燈作連續光源能可靠地測量高達2600°K的火焰溫度。要測量更高的火焰溫度,在尋求合適的光源方面遇到了困難。鈉線自蝕法測量的是有效的電子激發溫度。這種方法不能用於高度發亮的火焰,因為這種火焰的發射係數和鈉D線的發射係數相近,由於缺乏譜線和連續背景的明晰對比,檢測靈敏度不佳。
亦可用測定譜線的相對發射強度的方法來測量火焰溫度。選擇具有已知不同激發電位E和E以及躍遷幾率A和A的同一元素的兩條譜線,它們的強度,按照玻爾茲曼分布定律,分別為
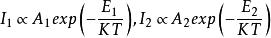 火焰溫度
火焰溫度只要測定了譜線相對強度,就可以計算出溫度T值。這方法的優點是不需要比較光源,困難是在於得到準確的躍遷幾率值和準確地測定譜線的相對強度。由於自吸收,不能選用共振線。
也可用測定相對原子吸收強度的方法來測量火焰溫度。
絕熱火焰溫度
簡單地說,當燃燒放出的熱量全部用來加熱氣態產物時,產物的溫度就是絕熱火焰溫度。本章開始我們曾提到,燃燒溫度是研究燃燒問題時最重要的參數之一。實際燃燒過程中的溫度要取決於釋熱和散熱兩個方面。絕熱火焰溫度雖然沒有考慮熱損失,但它是衡量可燃物特徵的一個尺度,以後我們將看到,它對火焰傳播特性等也有影響。因此,絕熱火焰溫度在許多燃燒問題中常被看作是一個相當重要的熱力學量。某些文獻給出的定義是:在一個孤立系統中的放熱反應,如使混合物從一個規定的初始壓力和初始溫度經過定壓且絕熱的過程達到化學平衡,系統達到的最終溫度稱為絕熱火焰溫度T,。由於不考慮熱損失顯然是一種理想情況,故又稱“理論火焰溫度”;由於與有熱損失的各種情況比較,這時達到的溫度將是最高的,故又稱“最高燃燒溫度”。不過這一定義並未考慮空氣和燃料的比例和惰性添加劑的影響,所以並不代表在最佳空燃比下所能達到的最高溫度。
如果燃燒前的反應物和燃燒後的最終產物的成分都是已知的,則絕熱火焰溫度可根據能量守恆原理求出。
詳細介紹
由於火焰溫度對化學反應速率所起到的作用,火焰溫度可能是燃燒最重要的一個性質。火焰溫度既可以通過實驗測量出來,又可以通過計算得到。為了方便起見,引入了絕熱火焰溫度的概念。絕熱火焰溫度指的是,在一定的初始溫度和壓力下,給定的燃料(包含燃料和氧化劑),在等壓絕熱條件下進行化學反應,燃燒系統(屬於封閉系統)所達到的終態溫度。在實際中,火焰的熱量有一部分以熱輻射和熱對流的方式損失掉了,所以絕熱火焰溫度基本上不可能達到。然而,絕熱火焰溫度在燃燒效率和熱量傳遞的計算中起到很重要的作用。對於高溫火焰(高於1800K),燃燒產物發生了分解反應,不但體積增大,還吸收了大量的熱量。在低溫時,化學當量比混合物或者貧燃料混合物燃燒後的產生應該只有CO和HO,然而這些產物很不穩定,只要溫度稍高一點,就可能部分轉變為成簡單的分子、原子和離子形式。相應地在轉變過程中,能量被吸收,最大火焰溫度也相應地被減小了。
火焰顏色為什麼不一樣?
火焰的實質是高溫的氣態或等離子態的物質。有兩種因素決定火焰的顏色:
一是火焰的溫度決定火焰的顏色,火焰是一種反應。低溫的時候是紅外線,隨著溫度的上升,火焰從紅色橙色(3000度)到黃色白色(4000度)到青色藍色(5000~6000度)到紫色(7000以上)到最後看不見的紫外線(幾萬度),顏色在不斷改變。從高能物理來說,紅外線,有色光譜段的火焰都是低能量的火焰,溫度繼續高下去,火焰的顏色從紫外線到x線到伽馬線等等,這些都是無法形容的“顏色”。
二是氣態和等離子態物質的元素構成決定火焰的固有光譜,元素表的每種元素高溫下都會發出自己特定的光色,常見的比如鈉會出現黃色,鉀是紫色,銅是綠色,化合物的光色是一種雜色,因為有許多種類的元素在發光。這也就是各種火焰的顏色不一樣的緣故。(詳見焰色反應)
舉例
烴完全燃燒火焰溫度的高低與燃燒熱的大小有關,但也不是完全有關的.如,乙烯的燃燒熱比乙炔的高.但是氧炔焰的溫度比乙烯的高。
乙烯和乙炔燃燒的熱化學方程式分別為:
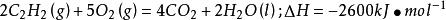 火焰溫度
火焰溫度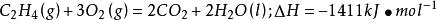 火焰溫度
火焰溫度燃燒熱是乙烯>乙炔,但火焰溫度是乙炔燃燒時高。乙炔在空氣或氧氣中燃燒,其火焰溫度可高達3200℃以上。乙炔的燃燒熱雖然比乙烷、乙烯等略低,但在完全燃燒時的耗氧量卻最少,產生物中的水含量相對較低,水蒸發所需熱量損耗較少,因此乙炔燃燒時能夠得到更高的溫度。
增加火焰溫度
因火焰強度增加(即在較小的體積內釋放出相同的總熱量),以及氮氣含量減少的結果,使火焰溫度提高,從而增強了火焰靠輻射和對流向周圍的熱傳導。據國外文獻報導,燃燒重油時,如把空氣中氧的濃度從21%增濃到22%,其理論燃燒溫度可提高80℃。