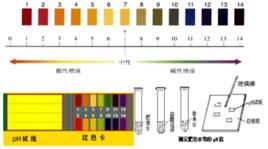
•3. pH的範圍:0—14 溶液酸鹼度和pH值的關係
| 溶液的pH值 | 溶液的酸鹼度 |
| <7 | 酸性溶液(pH越小,酸性越強) |
| =7 | 中性溶液 |
| >7 | 鹼性溶液(pH越大,鹼性越大) |
•(1)呈酸性的溶液不一定是酸溶液,如NaHSO溶液呈酸性,但屬於鹽溶液;呈鹼性的溶液不一定是鹼溶液,如NaCO溶液呈鹼性,但它也是鹽溶液。 (2)粗略測定溶液的酸鹼度常用pH試紙。
•pH的測定方法: 測定溶液pH通常用pH試紙和pH計。其中用pH試紙測定溶液pH的具體操作為:測定時,將pH試紙放在表面皿上,用乾淨的玻璃棒蘸取被測溶液並滴在pH試紙上,半分鐘後把試紙顯示的顏色與標準比色卡對照,讀出溶液的pH,簡記為:“一放、二蘸、三滴、四比”。 改變溶液pH的方法: 溶液的pH實質是溶液中H濃度或OH濃度大小的外在表現。改變溶液中H濃度或OH濃度,溶液的pH就會發生改變。 方法一加水:只能改變溶液的酸鹼度,不能改變溶液的酸鹼性,即溶液的pH只能無限地接近於7。 ①向酸性溶液中加水,pH由小變大並接近7,但不會等於7,更不會大於7(如下圖所示)。 ②向鹼性溶液中加水,pH由大變小並接近於7,但不會等於7,更不會小於7(如下圖所示)。 方法二加酸鹼性相同,pH不同的溶液:原溶液酸鹼性不會發生變化,但混合後溶液的pH介於兩種溶液之間: 方法三加酸鹼性相反的溶液:混合後發生中和反應,溶液的pH可能等於7,若加入的溶液過量,原溶液的酸鹼性就會與原來相反(如下圖所示)。
•pH值測定時的注意事項: ①不能直接把pH試紙浸入待測的溶液中,以免帶入雜質,同時還可能溶解pH試紙上的一部分指示劑,致使比色時產生較大誤差。 ②不能先用水將pH試紙潤濕再進行測定。因為將待測溶液滴到用水潤濕後的pH試紙上,其溶質質量分數將變小。 ③用pH試紙測得溶液的pH一般為整數。
•了解溶液的酸鹼度的重要意義: ①化工生產中許多反應必須在一定pH溶液里才能進行; ②在農業生產中.農作物一般適宜在pH為7或接近於7的土壤中生長; ③測定雨水的pH(因溶解有二氧化碳,正常雨水的pH約為5.6,酸雨的pH小於5.6),可以了解空氣的污染情況; ④測定人體內或排出的液體的pH,可以了解人體的健康狀況。 身邊一些物質的pH:
 溶液的酸鹼性與pH值
溶液的酸鹼性與pH值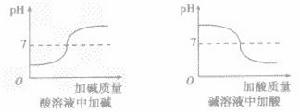 溶液的酸鹼性與pH值
溶液的酸鹼性與pH值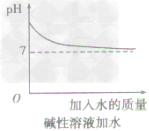 溶液的酸鹼性與pH值
溶液的酸鹼性與pH值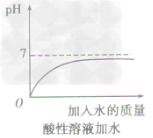 溶液的酸鹼性與pH值
溶液的酸鹼性與pH值 溶液的酸鹼性與pH值
溶液的酸鹼性與pH值 溶液的酸鹼性與pH值
溶液的酸鹼性與pH值