定義
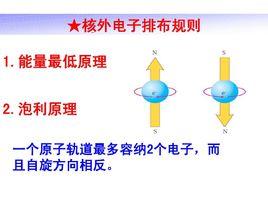
洪 特 根 據 大量 的 光 譜 實 驗 指 出 :電 子 在 能 量 相 同 的 軌 道 (即 等 價 軌 道 )上 排 布 時 ,總是儘可能分占不同的軌道且自鏇方向同向,因 為 這樣的排布方式總能量最低,稱為洪特規則(Hund’s rule)。
適用範圍
洪特規則只適用於LS 耦合的情況。有少數例外是由於組態相互作用或偏離LS 耦合引起的。該定則可用量子力學理論和泡利不相容原理來解釋。該定則對確定自由原子或離子的基態十分有用。
洪特規則前提
洪特規則前提:對於基態原子來說
在能量相等的軌道上,自鏇平行的電子數目最多時,原子的能量最低。所以在能量相等的軌道上,電子儘可能自鏇平行地多占不同的軌道。例如碳原子核外有6個電子,按能量最低原理和泡利不相容原理,首先有2個電子排布到第一層的1s軌道中,另外2個電子填入第二層的2s軌道中,剩餘2個電子排布在2個不同的2p軌道上,具有相同的自鏇方向,而不是兩個電子集中在一個p軌道,自鏇方向相反。作為洪特規則的補充,能量相等的軌道全充滿、半滿或全空的狀態比較穩定。
根據以上原則,電子在原子軌道中填充排布的順序為1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d…。
詳細信息
具體內容:對於特定電子排布,不同組態的LS耦合,洪特規則確定了能量排列順序:
(1)總自鏇S越大,能量越低
(2)S相等情況下,總軌道角動量L越大,能量越低
(3)在S和L都相等情況下,對於未滿半殼層或剛好半殼層,總角動量J越小能量越低,否則,J越大能量越低。
下面我們運用核外電子排布的三原則來討論核外電子排布的幾個實例。
氮(N)原子核外有7個電子,根據能量最低原理和泡利不相容原理,首先有2個電子排布到第一層的1s軌道中,又有2個電子排布到第二層的2s軌道中。按照洪特規則,餘下的3個電子將以相同的自鏇方式分別排布到3個方向不同但能量相同的2p軌道中。氮原子的電子排布式為1s2 2s2 2p3。這種用量子數n和l表示的電子排布方式,叫做電子構型或電子組態,右上角的數字是軌道中的電子數目。也可以用下式比較形象地表明這些電子的磁量子數和自鏇量子數:
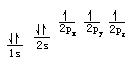 電子的磁量子數和自鏇量子數
電子的磁量子數和自鏇量子數氖(Ne)原子核外有10個電子,根據電子排布三原則,第一電子層中有2個電子排布到1s軌道上,第二層中有8個電子,其中2個排布到2s軌道上,6個排布到2p軌道上。因此氖的原子結構可以用電子構型表示為1s2 2s22p6。這種最外電子層為8電子的結構,通常是一種比較穩定的結構,稱為稀有氣體結構。
鈉(Na)原子核外共有11個電子,按照電子排布順序,最後一個電子應填充到第三電子層上,它的電子構型為1s2 2s2 2p6 3s1。為了避免電子結構式書寫過繁,也可以把內層電子已達到稀有氣體結構的部分寫成“原子實”,以稀有氣體的元素符號外加方括弧來表示,例如鈉原子的電子構型也可以表示為[Ne]3s1
鉀(K)原子核外共有19個電子,由於3d和4s軌道能級交錯,第19個電子填入4s軌道而不填入3d軌道,它的電子構型為1s2 2s2 2p6 3s2 3p6 4s1或[Ar]4s1。同理20號元素鈣(Ca)的第19,20個電子也填入4s軌道,鈣原子的電子構型為[Ar]4s2。
鉻(Cr)原子核外有24個電子,最高能級組中有6個電子。鉻的電子構型為[Ar]3d5 4s1,而不是[Ar]3d4 4s2。這是因為3d5的半充滿結構是一種能量較低的穩定結構。
作為洪特規則的發展,能量簡併的等價軌道全充滿、半充滿或全空的狀態是比較穩定的尤其是簡併度高的軌道更是如此。如
全充滿:p6,d10,f14
半充滿:p3,d5,f7
全空:p0,d0,f0
洪特規則之一
洪特規則是在等價軌道(指相同電子層、電子亞層上的各個軌道)上排布的電子將儘可能分占不同的軌道,且自鏇方向相同。後來經量子力學證明,電子這樣排布可能使能量最低,所以洪特規則也可以包括在能量最低原理中。
洪特規則之二
 洪特規則
洪特規則 洪特規則
洪特規則洪特規則 又稱等價軌道規則。在同一個電子亞層中排布的電子,總是儘先占據不同的軌道,且自鏇方向相同。如氮原子中的3個p電子分布於3個p軌道上並取向相同的自鏇方向。p軌道上有3個電子、d軌道上有5個電子、f軌道上有7個電子時,都是半充滿的穩定結構。另外量子力學的研究表明;等價軌道全空(p 、d 、)和全滿時(p 、d 、)的結構,也具有較低能量和較大的穩定性。像鐵離子Fe 3d )和亞鐵離子Fe (3d )對比看,從3d →3d 才穩定,這和亞鐵離子不穩定易被氧化的事實相符合。根據洪特規則鉻的電子排布式應為1s 2s 2p 3s 3p 3d 4s 。
洪特規則特例
當同一能級各個軌道上的電子排布為全滿、半滿或全空時,可使體系能量最低。
如24號元素鉻(Cr)電子排布為1s2 2s2 2p6 3s2 3p6 3d5 4s1
29號元素銅(Cu)電子排布為1s2 2s2 2p6 3s2 3p6 3d10 4s1
洪特規則的例外很多例如“原子軌道中,每一層半滿或全滿時能量最低”,也就是說s1、2,p3、6,d5、10,f7、14的時候能量最低也最穩定,是原子存在的一般形式,但是只要看元素周期表就會發現,排在下面幾行的幾類元素,尤其是鑭系和錒系元素沒有幾個符合洪特規則,這也是理論所無法解釋的。