相關概念
可逆電對
(1)能迅速建立起氧化還原平衡;
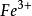 氧化還原滴定法
氧化還原滴定法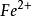 氧化還原滴定法
氧化還原滴定法(2)其電勢符合能斯特公式計算的理論電勢例: /、I/I
不可逆電對
 氧化還原滴定法
氧化還原滴定法(1)不能建立真正的平衡;
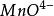 氧化還原滴定法
氧化還原滴定法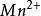 氧化還原滴定法
氧化還原滴定法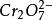 氧化還原滴定法
氧化還原滴定法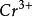 氧化還原滴定法
氧化還原滴定法(2)實際電勢與理論電勢相差較大例: /、 /
對稱電對
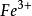 氧化還原滴定法
氧化還原滴定法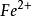 氧化還原滴定法
氧化還原滴定法氧化態與還原態的係數相同。例/
不對稱電對
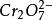 氧化還原滴定法
氧化還原滴定法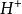 氧化還原滴定法
氧化還原滴定法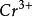 氧化還原滴定法
氧化還原滴定法 氧化還原滴定法
氧化還原滴定法氧化態與還原態的係數不同。I+2e =2I , +14 +6e =2 +7
由條件電勢考慮到溶液中的實際情況,在能斯特方程中引入相應的活度係數和副反應係數 有: 當C【Ox】=C【Red】=1時,得到條件電勢條件電勢的意義:表示在一定介質條件下,氧化態和還原態的分析濃度都為1mol/L時的實際電勢,在條件一定時為常數。
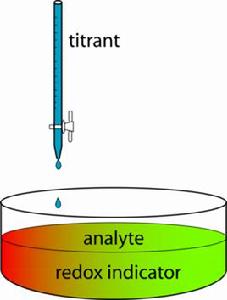
試劑選擇
它以氧化劑或還原劑為滴定劑,直接滴定一些具有還原性或氧化性的物質;或者間接滴定一些本身並沒有氧化還原性,但能與某些氧化劑或還原劑起反應的物質。氧化滴定劑有高錳酸鉀、重鉻酸鉀、硫酸鈰、碘、碘酸鉀、高碘酸鉀、溴酸鉀、鐵氰化鉀、氯胺等;還原滴定劑有亞砷酸鈉、亞鐵鹽、氯化亞錫、抗壞血酸、亞鉻鹽、亞鈦鹽、亞鐵氰化鉀、肼類等。
指示劑
氧化還原滴定的等當點可藉助儀器(如電位分析法)來確定,但通常藉助指示劑來判斷。有些滴定劑溶液或被滴定物質本身有足夠深的顏色,如果反應後褪色,則其本身就可起指示劑的作用,例如高錳酸鉀。而可溶性澱粉與痕量碘能產生深藍色,當碘被還原成碘離子時,深藍色消失,因此在碘量法中,通常用澱粉溶液作指示劑。本身發生氧化還原反應的指示劑,例如二苯胺磺酸鈉、次甲基藍等,則在滴定到達等當點附近時,它也發生氧化還原反應,且其氧化態和還原態的顏色有明顯差別,從而指示出滴定終點。
氧化還原指示劑
如二苯胺磺酸鈉在酸性溶液中以苯胺磺酸形式存在,無色,在被標準滴定溶液氧化時,生成二苯聯苯磺酸,紫色。
專用指示劑
能和氧化劑還原劑生成特殊色澤,明顯提高觀測靈敏度,如在碘量法滴定中,可溶性澱粉溶液和碘標準滴定溶液生成深藍色吸附性化合物,可逆。
自身指示劑
如高錳酸鉀標準滴定溶液滴定產品草酸時,滴定終點為高錳酸鉀標準滴定溶液的紫色。
預先操作
在氧化還原滴定中,往往需要在滴定之前,先將被測組分氧化或還原到一定的價態,然後進行滴定。這一步驟稱為預先氧化或還原處理。通常要求預處理時所用的氧化劑或還原劑與被測物質的反應進行完全,反應快,過量的試劑容易除去,並要求反應具有一定的選擇性。
試劑判斷
氧化還原不可分,得失電子是根本。失電子者被氧化,得電子者被還原。
失電子者還原劑,得電子者氧化劑。氧化劑 還原劑,相依相存永不離。
影響因素
氧化還原反應的反應機理往往比較複雜,常伴隨多種副反應,或容易引起誘導反應,而且反應速率較低,有時需要加熱或加催化劑來加速。這些干擾都需針對具體情況,採用不同的方法加以克服,否則會影響滴定的定量關係。