定義
某一電位下極化電阻是極化曲線在該電位處切線的斜率。
線性極化電阻只適用於極化曲線線性區域的極化測量。
 極化電阻
極化電阻電極上有(淨)電流流過時,電極電勢偏離其平衡值,此現象稱作極化。根據電流的方向又可分為陽極化和陰極化。
極化是指腐蝕電池作用一經開始,其電子流動的速度大於電極反應的速度。在陽極,電子流走了,離子化反應趕不上補充;在陰極,電子流入快,取走電子的陰極反應趕不上,這樣陽極電位向正移,陰極電位向負移,從而減小電位差,降低了腐蝕速率。
極化電阻方程式
根據混合電位理論,任何腐蝕電化學反應都是由 兩個或兩個以上的氧化還原反應組成。根據對極化曲線形狀的理論分析,在最簡單的情況下,假定腐蝕著的金屬電極上只進行著兩對電化學反應,並且:
(1)這兩對電化學反應受活化極化控制,他們的 過電位與陽極或陰極反應的電流密度均滿足Tafel方程;
(2)極化電位中不包括溶液電阻和金屬表面膜電 阻引起的歐姆電壓降;
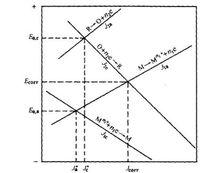 由兩對電化學反應組成的金屬腐蝕電極極化示意圖
由兩對電化學反應組成的金屬腐蝕電極極化示意圖(3)沒有濃度極化的干擾;
(4)體系的自腐蝕電位E相距局部陽極和局部陰極的平衡電位甚遠;
(5)除了這兩對電化學反應外,沒有二次電化學反應發生;
(6)把腐蝕著的金屬電極當作一個均勻的整體來對待。
當外電流為零時:
J1a=J2c=Jcorr;E=Ecorr
測量方式
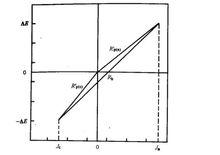 測定線性極化電阻的三種線性化處理示意圖
測定線性極化電阻的三種線性化處理示意圖在進行線性極化測量時,有三種線性化處理方式:
(1)陽極線性極化;
(2)陰極線性極化;
(3)雙方向線性極化。
測量難點
極化電阻測量已成為重要的腐蝕速度監測手段。現有的測量方法基本上是以Stern 公式為理論依據。由於Stern 公式最初是以指數展開後取線性近似而導出的,目前各種方法所測得的都是線性極化電阻。
 極化電阻
極化電阻然而這些方法的理論基礎和測量技術都遇到了一些困難。在理論基礎方面,Stern公式是在假定腐蝕過程只有一個陰極反應而且腐蝕過程的陰、陽極反應速度都遵循Tafel公式的前提下得出的。但大多數實際腐蝕體系並不滿足上述條件。
例如,在中性溶液中以氧為去極化劑的腐蝕過程,陰極反應速度一般並不適合Tafel式,而在酸性溶液腐蝕情況下,溶液中往往含有溶解氧或離子,陰極反應就不只一個。
在測量技術方面,會遇到下列三個方面的問題。
(1)由於線性近似引起的理論誤差;
(2)極化值大小的選擇;
(3)讀數的速度或測量頻率的選擇。