簡介
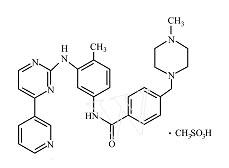 格列衛
格列衛格列衛,活性成份為甲磺酸伊馬替尼,為苯胺嘧啶的衍生物,是一特異性的酪氨酸激酶抑制劑(tyrosine kinases inhibitors,TKI)。2001年5月被FDA批准用於治療慢性粒細胞白血病(CML)。2003年被FDA批准用於治療胃腸道間質瘤(GIST)。
作用原理
伊馬替尼競爭性抑制ATP與TK受體如KIT的結合位點,阻滯TK磷酸化,從而抑制信號傳導,並可抑制與激酶活性相關的KIT突變(引起KIT受體活化)和野生型的KIT。通過功能獲得性KIT突變引起不依賴幹細胞因子的激活作用來減少來自GIST的細胞系(GIST882)的激酶磷酸化,當濃度達到1μmol/L時,可完全抑制激酶磷酸化。
用法用量
治療CML
 格列衛
格列衛3歲以上兒童及青少年:慢性期260mg(最大劑量:400mg);加速期和急變期:340mg(最大劑量:600mg)。
尚無3歲以下兒童治療的經驗。
治療GIST
對不能切除和/或轉移的惡性GIST患者,該品的推薦劑量為400mg/日。在治療後未能獲得滿意的反應,如果沒有藥物不良反應,劑量可考慮從400mg/日增加到600mg/日。對於GIST病人,該品應持續治療,除非病情進展。
不良反應
多數患者在服用該品期間會出現一些不良反應,但絕大多數屬輕到中度。考慮到疾病本身也會產生症狀,常難以明確它們的因果關係。
在CML的臨床試驗過程中,因藥物相關的不良反應而停藥者,在α-干擾素治療失敗的慢性期患者中僅占1%,加速期中約占2%,急變期占5%。
在GIST臨床試驗中,因藥物相關的不良事件而停藥者占3.4%。
CML和GIST病人發生的不良反應相似,只有兩種例外:GIST病人發生骨髓抑制較少,腫瘤內出血僅在GIST病人中觀察到。
注意事項
在CML和GIST病人中,最常見報告的與藥物治療相關的不良事件有輕度噁心(50%-60%),嘔吐,腹瀉、腹痛、乏力、肌痛、肌痙攣及紅斑,這些不良事件均容易處理。
所有研究中均報告有浮腫和水瀦留,發生率分別為47%~59%和7%~13%,其中嚴重者分別為1%~3%和1%~2%。大多數患者的浮腫表現為眶周和下肢浮腫。曾有青光眼的個別報告,與水瀦留有關。也有胸水、腹水、肺水腫和體重迅速增加的報告。這些事件通常可採用暫停使用該品、使用利尿劑或給予其它支持治療而得以緩解。但是個別患者情況嚴重,甚至威脅生命。有1例急變期患者因並發胸水、充血性心力衰竭和腎功能衰竭的複雜臨床情況而死亡。這些不良事件的發生率與劑量有一定關係,多見於劑量>600mg/天時。
當伊馬替尼與高劑量的化療藥聯合使用時,可發生一過性的肝毒性,如轉氨酶升高及高膽紅素血症。
藥物相互作用
影響
 格列衛
格列衛CYP3A4誘導劑:健康志願者服用利福平後,伊馬替尼的清除增加3.8倍(90%可信區間=3.5-4.3倍),但Cmax,AUC(0-24)和AUC(0-8)分別下降54%、68%和74%。在臨床研究中發現,同時給予苯妥英藥物後,甲磺酸伊馬替尼的血漿濃度降低,從而導致療效減低。其它誘導劑如地塞米松、卡他咪嗪、苯巴比妥和含有StJohn麥汁浸膏製劑等,可能有類似問題,因此應避免伊馬替尼與CYP3A4誘導劑同時服用。
被影響
甲磺酸伊馬替尼使辛伐他丁的平均Cmax和AUC分別增加2倍和3.5倍。應謹記伊馬替尼可增加經CYP3A4代謝的其他藥物(如苯二氮類、雙氫吡啶、鈣通道拮抗劑、和其它HMG-CoA還原酶抑制劑等)的血漿濃度。因此當同時服用本藥和治療窗狹窄的CYP3A4底物(如環孢素、匹莫齊特)時應謹慎。
在與抑制CYP3A4活性相似的濃度下,甲磺酸伊馬替尼還可在體外抑制CYP2D6的活性,因此在與甲磺酸伊馬替尼同時服用時,有可能增加系統對CYP2D6底物的暴露量,儘管尚未作專門研究,建議慎用。
甲磺酸伊馬替尼在體外還可抑制CYD2C9和CYD2C19的活性,同時服用華法林後可見到凝血酶原時間延長。因此在甲磺酸伊馬替尼治療的始末或更改劑量時,若同時在用雙香豆素,應短期監測凝血酶原時間。
藥理毒理
臨床前安全性數據
在經伊馬替尼長期治療後,大鼠機會性感染的發生率增加,並且猴子體內通常被抑制的瘧疾感染病情加重。
致突變性
在一項體外哺乳細胞基因碎片(clastogenicity)分析中(中國地鼠卵巢細胞染色體畸變),當代謝激活時,發現伊馬替尼有陽性的基因毒作用。
生殖毒性
對雄性動物精子的產生有輕度到中度降低;孕鼠活胎數降低。
致癌性
尚未進行致癌研究。
臨床試驗
慢性髓性白血病臨床研究
對費城染色體陽性的慢性髓性白血病急變期(髓性原始細胞危象)、加速期和經α-干擾素治療失敗的慢性期患者進行了三項開放、非對照性的II期臨床研究。
在一項大規模、開放、對照的III期臨床試驗中,病人為新診斷的費城染色體陽性的慢性白血病(費城+CML)。對兒童和青少年的治療在兩項I期研究中進行。臨床研究病例中,38%-40%患者的年齡≥60歲,10~12%≥70歲。
新診斷的慢性期:一項在之前6個月內首次診斷為CML的1106名患者入組的III期臨床試驗中,比較甲磺酸伊馬替
尼400毫克/天和α-干擾素(INF)5百萬IU/m2/天+阿糖胞苷(Ara-C)20毫克/m2/天(10天/月)的療效。80%的病人在服用試驗
藥物前曾接受羥基脲的治療,在試驗的最初6個月,50%服用甲磺酸伊馬替尼的病人和75%服用IFN-Ara-C的病人也同時繼續服用羥基脲(平均分別為
15和30天)。
在12個月後的中期分析,甲磺酸伊馬替尼組和IFN-Ara-C組的完全血液學反應(CHR)分別為94.4%和54.6%,主要細胞遺傳學反應為82.6%和20.3%,完全細胞遺傳學反應為67.8%和7.4%。
採用經驗證的FACT-BRM問卷評價生活質量,甲磺酸伊馬替尼組所有方面的評分均高於IFN-Ara-C組, 生活質量數據表明, 接受甲磺酸伊馬替尼治療的病人能夠保持心情愉快。
a-干擾素治療失敗的慢性期患者:(532例,起始劑量400毫克,每日一次)60%的患者獲得了主要細胞遺傳學反應,42%獲得了完全緩解,93%獲得了完全血液學反應。
加速期:(235例,其中63%患者在加速期已接受過其他治療,235例患者中77例接受甲磺酸伊馬替尼400毫
克,每日一次;158例接受600毫克,每日一次)。結果70%患者獲得確切的血液學反應,28%患者獲得完全血液學反應,25%患者獲得主要的細胞遺傳
學反應(即分裂中費城染色體陽性細胞減少到<35%)18%獲得完全細胞遺傳學緩解。以血液學緩解為主要終點的分析,發現400毫克和600毫克劑
量組之間無明顯差異,但600毫克劑量組的細胞遺傳學反應改善更明顯,其持續時間更長。本研究中,600毫克劑量組的至疾病出現進展時間明顯不同。
急變期(髓性原始細胞危象):(260例,95例[37%]在進入加速期或急變期後均已接受過化療,另165例
[63%]此前未接受過化療。223例開始治療的劑量為600毫克,每日一次)。以不同的完全血液學反應作為主要療效進行統計,31%的患者獲得了肯定的
血液學反應(未接受過治療患者為36%,經過治療的患者為22%),15%患者觀察到主要細胞遺傳學反應。未接受和接受過治療的患者的中位生存時間分別為
7.7和4.7個月。
兒童和青少年:CML慢性期(15人)或CML急變期或費城染色體陽性的急性白血病(16人)共31名兒童患者入組
一項劑量逐漸增大的I期試驗,其中28%的CML患者年齡在2-12歲,50%在12-18歲。病人按下列劑量接受甲磺酸伊馬替尼,260毫克/m2/天
(n=6)、340毫克/m2/天(n=11)、440毫克/m2/天(n=8)和570毫克/m2/天
(n=6)。在獲得了細胞遺傳學資料的13例CML病人中,7人
(54%)獲得完全細胞遺傳學反應, 4人(31%)獲得部分細胞遺傳學反應,其相當於85%的主要細胞遺傳學反應率。另有8名患兒(3名CML, 4名
急性白血病)進行另一項I期試驗,3人接受的劑量為173-200毫克/m2/天,4人接受的劑量約為260毫克/m2/天,1人接受360毫克/m2
/天的劑量。3名CML患兒中有兩人獲得完全細胞遺傳學反應。與成人試驗相比,總共39名兒童中沒有特別的安全性問題。
胃腸道間質腫瘤(GIST)的臨床研究
對不能手術切除或轉移的胃腸道間質腫瘤(GIST)病人進行了一項開放、隨機、多國家參加的II期臨床試驗。在這項
試驗中,共入選147例病人並隨機接受口服伊馬替尼400毫克或600
毫克治療,每日一次,平均治療6-12個月(不超過24個月)。這些病人的年齡在18-83歲範圍內,病理診斷為C-Kit-陽性的惡性胃腸道間質腫瘤
(GIST),且不能手術切除和/或為轉移性。
400毫克組的緩解率為37%,600毫克組為43.2%,沒有完全緩解病例。
截止到平均隨訪7個月(7天-13個月)時,所有緩解的病人未出現病情進展。
藥代動力學
該品藥代動力學是單劑量口服及達穩態後評價的,劑量範圍在25-1000mg。
該品劑量在25-1000mg範圍內,其平均曲線下面積(AUC)的增加與劑量間存在比例性關係。重複給藥的藥物累積量穩態時在1.5-2.5倍。成人人群藥代動力學研究表明,性別對藥代動力學無影響,體重的影響也可略而不計。
吸收
膠囊劑的平均絕對生物利用度為98%,口服一次該品後血漿AUC的變異係數波動在40%~60%之間。與空腹時比較,高脂飲食後本藥吸收率減少甚微(Cmax減少11%,tmax延後),AUC略減少(7.4%)。
分布
約95%與血漿蛋白結合,絕大多數是與白蛋白結合,少部分與α-酸性糖蛋白結合,只有極少部分與脂蛋白結合。整個機體內的總體分布濃度較高,分布容量為4.91/千克體重,但紅細胞內分布比率較低。體內組織中有關藥物分布情況僅來源於臨床前的資料。腎上腺和性腺中攝取水平高,中樞神經系統中攝取水平低。
代謝
人體內主要循環代謝產物是N-去甲基哌嗪衍生物,在體外其藥效與原藥相似。該代謝物的血漿AUC是原藥甲磺酸伊馬替尼AUC的16%。甲磺酸伊馬替尼是CYP3A4的底物,又是CYP3A4、CYP2D6、CYP2C9和CYP2C19的抑制劑,因此,可影響同時給予藥物的代謝。
消除
甲磺酸伊馬替尼的清除半衰期為18小時,其活性代謝產物半衰期為40小時,7天內約可排泄所給藥物劑量的81%,其中從大便中排泄68%,尿中排泄13%。約25%為原藥(尿中5%,大便中20%),其餘為代謝產物,在糞便和尿中活性代謝產物和原藥的比例相似。
特殊病人群
給予同樣的劑量(400mg/天),GIST患者其穩態時的藥物暴露量是CML患者的1.5倍。依據初步的GIST病人的人群藥代動力學研究,伊馬替尼的藥代動力學有3項指標的變化(白蛋白、WBC和膽紅素)在統計學上有顯著性影響。低白蛋白水平降低清除(CL/f),正如較高的WBC水平。但是這些影響並不足以斷定劑量需要調整。
兒童用藥
兒童和青少年260mg和340mg的使用劑量會產生同樣的藥物暴露,分別相當於成人的400mg和600mg。以340mg/天的劑量經每日一次重複給藥後,第8天和第1天的AUC(0-24)比揭示出有1.7倍的藥物蓄積。
肝腎功能衰竭
對肝、腎功能衰竭病人未進行過臨床研究,這些患者套用甲磺酸伊馬替尼時要謹慎。已知甲磺酸伊馬替尼的排泄很少經腎臟,估計腎功能衰竭患者服用不會出現問題。
貯藏
30℃以下保存。
包裝
0.1g/片:PVC-鋁泡罩包裝,60片/盒
0.49/片:PVC/PE/PVDC-鋁泡罩包裝,30片/盒
有效期
36個月。
執行標準
進口藥品註冊標準JX20040087
生產企業
NovartisPharmaSteinAG,Switzerland
委託企業
NovartisPharmaSchweizAG
核准日期
2007年11月06日
修訂日期
2008年5月15日2009年1月24日2009年5月15日2010年4月16日2010年5月7日2010年12月10日
