概述
擴散電位diffusionpotential在電解質的鹽溶液中當從濃度高的一側向濃度低的一側擴散時,在組成鹽的陰、陽兩種離子的淌度存在差別的情況下,淌度高的離子就領先,淌度低的離子就遲後,因為這種關係溶液中就產生了電位差,這就是擴散電位。例如在NaCl溶液中由於CI-的淌度比Na+大,所以濃度大的部分的電位就比濃度小的部分為正。
原理
這裡u+和u-是陽離子和陰離子的淌度,c1、c2是鹽的濃度,F是法拉第常數,R是氣體常數,T是絕對溫度。兩種液體用膜隔開,如膜只允許陽離子通過時,u-=0.由此可得:
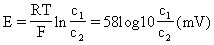 擴散電位
擴散電位這就是能斯特公式。KCl由於K+和Cl-兩離子的淌度相等,不產生擴散電位。因此當兩個組成和濃度都不一樣的電解質溶液要發生電的接觸時,兩者用飽和KCl的鹽橋連線就不產生擴散電位。
