基本信息
書名:工業鍋爐水處理技術
圖書編號:1225829
出版社:氣象出版社
定價:29.5
ISBN:750292918
作者:郝景泰
出版日期:2003-08-01
版次:1
開本:小32開
簡介
本書全面而系統地介紹了工業鍋爐水處理的基本知識,包括鍋爐基本知識,水的鍋爐內、鍋爐外化學藥劑處理,水的預處理、離子交換處理及自動再生離子交換器的運行操作技術,鍋爐結垢、腐蝕的原因和防止措施,鍋爐的化學清洗 ,水質標準及水質分析方法等,附錄中提供了一些常用的數據資料以備查用。
本書經國家質量技術監督局鍋爐壓力容器安全監察局審定,可作為從事低壓鍋爐水處理運行和檢驗人員的培訓教材,也可作為與此書所介紹的技術有關的設計和管理人員的參考書。
目錄
第一章 化學基礎知識
第一節 化學的基本概念
一、物質的組成
二、元素和元素符號
三、原子的構成
四、分子、他子式與化合價
五、常見的化學反應及運用化學方程式的有關計算
第二節摩爾及物質的量
一、摩爾
二、摩爾質量
三、物質的量
四、溶液的濃度及其表示方法
第三節 酸、鹼、鹽、氧化特及其絡合物
一、酸及其一般性質
二、鹼及其一般性質
三、鹽及其一般性質
四、氧化物及其一般性質
第四節 化學反應速度與化學平衡
一、化學反應速度
二、化學平衡
第五節電離平衡
一、電解質及其電離
二、弱電解質及其電離
三、水的電離及其pH值
四、緩衝溶液
五、離子反應式
六、鹽類的水解
第二章 鍋爐用水概述
第一節 天然水的特點及我國天然水的分布
一、天然水的特點
二、我國天然水分布的特點
第二節 天然水中的雜質
一、懸浮物
二、膠體
三、溶解物質
第三節 碳酸化合物的存在形態與pH值的關係
一、碳酸化合物的存在形態
二、碳酸化合特的形態與pH值的關係
三、pH、[HCO3]和[CO*2]的關係
四、pH值和各種碳酸化合特相對含量之間的關係
第四節 鍋爐用水的水源及其名稱
一、鍋爐用水的水源
二、鍋爐用水的名稱
第五節 水質不良對鍋爐的危害
……
第三章 鍋爐基本知識
第四章 鍋爐的腐蝕與保護
第五章 水垢的形成與防止
第六章 鍋內加藥處理方法及其排污
第七章 水的預處理
第八章 鍋外離子交換水處理
第九章鍋爐化學清洗
第十章 水質分析方法
第十一章 溶液的配製與標定方法
附錄
鍋爐水處理水質處理及基礎理論
一、內容系統圖
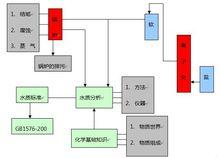 內容系統圖
內容系統圖二、化學基礎知識
⒈ 化學基本概念
⑴ 元素:是具有相同核電核數的同一類原子的總稱.
⑵ 分子:是保持原物質的一切性質的最小微粒。
⑶ 原子:是物質進行化學反應的最小微粒。
⑷ 化學變化:物質本身發生變化,生成一種或幾種新的物質的變化。
⑸ 物理變化:物質沒有發生本質的變化。
⑹ 摩爾質量:1摩爾物質的質量,叫做摩爾質量。也就是6.02*(10)23個分子或原子的總量。符號常用M表示,單位是克/摩爾﹝g/mol﹞。
⑺ 原子量:把一種碳原子(原子核內有6個質子和6箇中子)的質量定為12作標準,而把其他原子的質量與它相比較,所得出的數值就是該原子的原子量。
⑻ 電解質:把溶解於水或熔融狀態下能夠導電的物質。
⒉ 物質的組成
世界是由物質組成的;構成物質的元素只有109種。
⒊ 物質的分類單質:以單質存在的分子。(例:Au、S、C等等)
⑴ 有機物:(無)
純淨物 酸:電離生成的陽離子全部是氫離子,就叫酸。
無機物: 化合物 鹼:電離生成的陰離子全部是氫氧根離子,就叫鹼。 鹽: 電離生成的有酸根與金屬離子的,就叫鹽。
混合物:由不同種分子存在的物質。
三、鍋爐用水及水質分析
⒈ 鍋爐用水的水源
⑴ 地表水:由雨水、雪水匯聚而成並存在於地殼表面的水。
特點:受自然界影響較大水當中的懸浮物可溶解鹽類隨著季節的不同變化幅度較大。
地下水:也是有雨水雪水和地表水經過地層的滲流而形成。 特點:由於在地層的滲透過程當中通過土壤和砂粒過濾作用去除了大部分的懸浮物和菌類,又由於與大氣層和水界隔絕,水體不容易受到污染,但是,因水流經各類礦層,所以地下水中的鹽量通常比地表水高。
自來水:由天然水經過自來水廠淨化處理後經過管子輸送到用戶的水。 特點:由於淨化的過程當中,投加混凝劑、殺菌劑等藥物,所以自來水中懸浮物、有機物和鹼度都明顯降低,但為了防止自來水中微生物的繁殖,通常向水中投加漂白粉或注入氧氣,當這種成分過量時,對離子交換樹脂具有較大的破壞作用。
⒉ 鍋爐用水的雜質
⑴懸浮物: 顆粒≥10mm
懸浮物的危害:①進入離子交換器後污染離子交換樹脂,降低交換劑的容量。
② 影響出水水質和進水量。
③進入鍋爐後受熱很快下沉影響鍋爐的傳熱和鍋水循環,嚴重時可堵塞爐管造成停爐。
⑵膠體: 顆粒10mm~10mm
特點: 有較小的直徑,較大的表面積,膠體通常帶有相同的電荷.雖經較長時間靜止也較難自然下沉。
危害: 進入鍋爐後很快下沉形成沉積物,並在受熱面上形成水垢泥和水渣,有機膠體引起鍋水起沫,當濃縮到一定程度時會產生汽水共騰。
⑶溶解物質: 顆粒 <10mm 主要是溶解在水中陰—陽離子及氣體雜質。
陽離子:Ca、Mg等反應生成水垢。
①離子雜質:
危害: 陰離子:碳酸根、硫酸根等反應生成酸。
氧氣:溶解氧對金屬有強烈的腐蝕作用。
②氣體雜質:
二氧化碳:溶解於水中的二氧化碳具有酸性
對金屬直接產生腐蝕,而且破壞金屬的保護
膜,從而加劇氧腐蝕。
⒊ 鍋爐用水的名稱
⑴ 原水—俗稱生水,沒有經過任何淨化處理的水。
①清水:鍋內加藥使用的水。
⑵ 給水— ②軟水:去除了硬度的水。(鍋外化學處理)
③除鹽水:去除了水中全部陰陽離子的水。(高壓鍋爐)
⑶ 鍋水—受熱沸騰的水(在鍋內)
①上排污:也稱連續排污,排放掉含鹽量、油污、泡沫等。
⑷ 排污水—
②下排污:也稱定期排污,排放掉水垢、水渣、泥垢等
排放掉一部分含鹽量高和水污水垢的鍋水。
⒋ 給水水質不良對鍋爐的危害
⑴ 結垢
⑵ 腐蝕
⑶ 影響蒸氣的品質
⒌ 水質指標和水質標準
水質:是指水和其中雜質所共同表現出來的綜合特性。
水質指標:表示水中雜質的種類和含量,用來判斷水質的優劣。
鍋爐的水質指標
⑴ 懸浮物:①懸浮固形物 單位mg/L ②濁度 單位FTU
⑵ 含鹽量:①導電率 ②溶解固形物單位
⑶ 硬度(YD):構成硬度金屬陽離子 ①鈣硬度 ②鎂硬度 ③碳酸鹽硬度④暫時硬度 ⑤永久硬度(非碳酸鹽硬度)
⑷ 鹼度(JD): (構成鹼度非金屬陰離子)單位
鹼度的成分: ①天然水中: 碳酸氫根
②鍋水:氫氧根和碳酸根
酚酞鹼度
鹼度的分類:
甲基橙鹼度
JD全=JD酚﹢JD甲
酚酞指示劑PH終點8.2~8.4
甲基橙指示劑PH終點4.2~4.5
⑸PH值: 鍋水10~12 防垢防腐 能形成保護膜
⑹ 溶解氧 單位 mg/L
⑺ 含油量 單位 mg/L
⑻ 有機物
⑼ 亞硫酸鹽 單位 mg/L
⑽ 磷酸鹽 單位 mg/L
⒍ 水質指標間的關係
⑴ 硬度與鹼度之間的關係
| YDT | YDF | YD負 | |
| YD>JD | JD | YD﹣JD | 0 |
| YD<JD | YD | 0 | JD﹣YD |
| YD=JD | YD | 0 | 0 |
⑵ 鹼度與PH值之間的關係
鍋水鹼度=CO2﹢OH
合格了鹼度一定合格,反之異然。
PH 值=OH
四、鍋內加藥處理方法
⒈基本原理
⑴防垢機理: 鍋內加藥機理是向鍋內投加合適的藥劑與鍋水中的結垢物質發生化學或物理作用生成水渣,通過鍋爐的排污,達到防止或減輕鍋爐結垢和腐蝕的目的。
⑵關於“軟化”含義的說明
鍋外化學處理—完全是化學反應的過程。
區別
鍋內加藥處理—化學反應與物理反應並存。
⒉ 鍋水中的沉澱物的形態及改變方法
⑴ 沉澱物的形態
①水渣—懸浮在鍋水中
②水垢—積附在鍋爐金屬受熱面上
⑵ 改變沉澱物的方法
創造條件使水垢變成水渣向鍋水中引入水渣的結晶核心投加高分子聚合物創造鍋爐受熱面清潔條件 ⑶ 使用特點
水處理設備簡單投資小,操作方便鍋內加藥是最基本的水處理方式,又是鍋外化學處理的延續鍋內加藥使用的配方它需與給水水質匹配鍋內加藥對環境幾乎沒有污染,非常環保 ⒊ 鍋內加藥處理常用藥劑
⑴ 防垢劑—也叫軟化劑,主要消除給水中的硬度。
鹼性藥劑有機膠體水質穩定劑 ⑵ 降鹼劑
⑶ 緩蝕劑
⑷ 消沫劑
⑸ 防油垢劑
⒋ 國內常用水處理藥劑的性能
⑴NaOH (燒鹼)
作用:① 能夠有效的去除給水中的碳酸鹽硬度
② 保持鍋水的鹼度,調節PH值防止鍋爐腐蝕
⑵Na2CO3 (純鹼)
作用:① 能夠有效的消除水中的鈣鎂離子
② 在鍋內Na2CO3可以部分水解成NaOH所以具有NaOH的作用
③ 保持鍋水的鹼度
⑶Na3PO4·12H2O(磷酸三鈉)
作用:① 它能沉澱給水中的鈣鎂鹽類
② 增加泥垢的流動性
③ 能夠使硫酸鹽和碳酸鹽等老的水垢脫落
④ 保持鍋水的鹼度,防止金屬的腐蝕
⑷ 磷酸氫二鈉和磷酸二氫鈉
作用: 與磷酸鈉相似,不同是能夠降鹼度
⑸ 六偏磷酸鈉
作用:① 可以消除由於水質硬度而引起的給水系統注水器堵塞的故障
② 可以代替磷酸二氫鈉
⑹ 栲膠(紅色)
作用:① 在金屬表面生成中性的絕緣層
② 防止結晶的生成
③ 能夠使老的水垢脫落
④ 能夠吸收水中的溶解氧
⒌ 幾種常用的鍋內加藥的方法
⑴ 天然鹼法 當JD>YD時 當YD>4mmol/L 帶有負鹼度的水作為給水直接使用
⑵ 加鹼處理
⑶ 有機防垢劑處理
⑷ 複合防垢劑
⑸ 其他方法
⒍ 鍋內加藥應注意的問題
⑴ 先除垢再防垢
⑵ 運行控制與管理
⑶ 鍋爐的排污,先排污在加藥
⑷ 定期停爐檢查
⑸ 水處理方法的選擇
⒎ 工業鍋爐水質標準(GB1576 — 2001)
| 項目 | 給水 | 鍋水 | |||||
| 額定蒸氣壓力,MPa | ≤1.0 | >1.0≤1.6 | >1.6≤2.5 | ≤1.0 | >1.0≤1.6 | >1.6≤2.5 | |
| 懸浮物,mg/L | ≤5 | ≤5 | ≤5 | – | – | – | |
| 總硬度,mmol/L | ≤0.03 | ≤0.03 | ≤0.03 | – | – | – | |
| 總鹼度,mmol/L | 無過熱器 | – | – | – | 6~26 | 6~24 | 6~16 |
| 有過熱器 | – | – | – | – | ≤14 | ≤12 | |
| PH(25℃) | ≥7 | ≥7 | ≥7 | 10~12 | 10~12 | 10~12 | |
| 溶解氧,mg/L | ≤0.1 | ≤0.1 | ≤0.05 | – | – | – | |
| 溶解固形物,mg/L | 無過熱器 | – | – | – | <4000 | <3500 | <3000 |
| 有過熱器 | – | – | – | – | <3000 | <2500 | |
| SO3, mg/L | – | – | – | – | 10~30 | 10~30 | |
| PO4,mg/L | – | – | – | – | 10~30 | 10~30 | |
| 相對鹼度(游離NaOH/溶解固形物) | – | – | – | – | <0.2 | <0.2 | |
| 含油量,mg/L | ≤2 | ≤2 | ≤2 | – | – | – | |
| 含鐵量,mg/L | ≤0.3 | ≤0.3 | ≤0.3 | – | – | – | |
五、鍋外離子交換水處理
⒈ 離子交換劑:
當水通過時,能將本身所含的某種離子與水中帶有相同電荷的離子進行交換
| Ca Mg |
| Ca Mg |
⒉ 軟化原理2RNa﹢ R ﹢ ﹢2Na
⒊ 鈉離子的交換再生
| Ca Mg |
| Ca Mg |
R ﹢2Na 2RNa﹢
⒋ 影響再生效果的因素
⑴ 再生方式:① 順流再生(用鹽較多)
② 逆流再生(效果好,省鹽)
⑵ 再生劑用量
Mz=VR*E*K*M/∈×1000 Kg
VR: 樹脂填裝體積
E:工作交換容量(800~1500mol/㎡*m)
K: 比耗(逆流取1.2~1.8 ,順流取2~2.5)
M: 再生劑的摩爾量(例:Na=23 , Cl=35.5 NaCl=23+35.5=58.8)
∈: 再生劑的純度
⑶ 再生濃度 (濃度比:5﹪/1/3~10﹪/2/3)
⑷ 再生液的流速(化學反應有一個滯後的過程一般流速4~8m/h 無頂壓逆流2~4m/h)
⑸ 再生液的溫度(一般取50℃再生效過最好)
⑹ 再生劑純度
⒌ 順流離子交換器的再生操作
反洗 進再生液(從上往下) 置換 正洗 運行
⒍ 全自動離子交換軟水器
⑴ 時間型:——單機單柱,再生方式:順流. 適用間歇運行鍋爐
組成設備—①控制器 ②交換柱 ③鹽水罐
⑵ 流量型:——單機雙柱或以上,再生方式:順流. 適用連續運行鍋爐
⑶ 運行天數的計算
(時間型)Q=VR·E/YD·Qd·T
VR: 樹脂填裝體積
E: 工作交換容量
Qd: 單位時間的產水量
T: 原水的硬度
(流量型)Q=VR·E·∈/YD
VR: 樹脂填裝體積
E: 工作交換容量
∈: 餘量
YD:原水硬度
六、水質的測定
⒈ 給水硬度的測定:( 絡合反應)
酒紅色 蘭色
⑴ 取給水水樣100mL,然後加5mL氨-氯化銨緩衝液.
⑵ 在溶液中滴加2-3滴鉻黑T指示劑,此時溶液呈酒紅色
⑶ 用EDTA標準溶液滴定至終點,此時溶液呈蘭色,並記錄下來消耗EDTA的體積.
計算公式:
![工業鍋爐水處理技術[圖書教材]](/img/7/c50/wZwpmLzQDNzcjNwMTN0ETN1UTM1QDN5MjM5ADMwAjMwUzLzUzLzIzLt92YucmbvRWdo5Cd0FmL0E2LvoDc0RHa.jpg) 工業鍋爐水處理技術[圖書教材]
工業鍋爐水處理技術[圖書教材]YD=C1V1/V×1000 = mmol/L
C1: EDTA標準溶液的濃度 mol/L
V1: 消耗EDTA的體積 ml
V: 取樣的體積 ml
試劑:
EDTA—0.01 1/2 EDTA
PH=10 氨-氯化銨--緩衝液(用來調試PH值)
0.5﹪ 鉻黑T指示劑
⒉ 鍋水的全鹼度的測定(中和反應)
⑴ 取50ml鍋水水樣,滴加2-3滴的酚酞指示劑,此時溶液呈紅色.
⑵ 用H2SO4標準溶液滴定至終點,此時溶液呈無色,記錄下消耗H2SO4的體積V1
⑶ 再在溶液中滴加2-3滴甲基橙指示劑,此時溶液呈黃色
⑷ 再用H2SO4標準溶液滴定至終點,此時溶液呈橙紅色,記錄下來消耗H2SO4的體積V2
計算公式:
JD全=C(V1+V2)/V×1000 = mmol/L
C : H2SO4的濃度
V1V2 :分別是滴加酚酞指示劑和甲基橙指示劑時消耗H2SO4的體積
V : 水樣的體積
試劑:
1﹪酚酞指示劑
1﹪甲基橙指示劑
0.1mol/L 1/2 H2SO4
⒊ 鍋水氯離子含量的測定
⑴ 取10ml鍋水水樣,加40ml蒸餾水
⑵ 加2-3滴酚酞指示劑,此時溶液呈紅色,用H2SO4滴定至無色
⑶ 滴加0.5ml鉻酸甲指示劑,此時溶液呈黃色
⑷ 用AgNO3標準溶液滴定到終點,此時溶液呈橙紅色
⑸ 記錄下來消耗的體積V1
⑹ 作空白實驗,記錄下消耗AgNO3的體積V2
計算公式:
CL~=(V1-V2) ×T/V ×1000 = mg/L
V1: 消耗AgNO3的體積
V2: 作空白實驗時消耗AgNO3的體積
V : 水樣體積
試劑:
1﹪酚酞指示劑
0.1mol/L硫酸
T=1.0mg/ml的AgNO3
