背景介紹
雙光子激發( two-photon excitation, TPE)是最簡單的多光子激發( multi-photon excitation, MPE)過程。雙光子激發理論最早由Goppert-Mayer於20世紀30 年代提出, 1961 年得到了實驗驗證。1990年, Denk等將雙光子激發用於螢光激發系統,製造出了世界上第一台雙光子掃描顯微鏡,並套用於生物學觀測。1997年,美國伯樂( Bio-Rad)公司首次製造出商業化的多光子顯微鏡。雙光子雷射掃描顯微鏡( tw o-pho to n laser sca nning micro scopy ,TPLSM)一經問世,很快被套用於神經信號傳導、生物代謝過程及其藥物 研究等生物學研究領域,取得了一系列顯著成果。
多光子技術原理
多光子激發基本物理原理
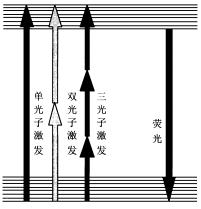 單光子與多光子激發示意圖
單光子與多光子激發示意圖通常情況下,一個分子或者原子每次只能吸收一個光子 ,從基態躍遷到激發態。 當光強足夠高時,就會產生多光子躍遷,即一次可以吸收多個光子。以螢光物質的雙光子吸收為例: 螢光分子同時吸收兩個相同頻率的光子 ,被激發至高能級,經過一個弛豫過程後發生自發躍遷,輻射出一頻率略小於兩倍入射光頻率的螢光光子。 由此推出:
(1) 螢光分子的多光子激發需要的雷射波長比單光子長。例如 ,雙光子激發 需要的雷射波長大約是單光子激發所需雷射波長的一倍。因此多光子激發能夠用紅外或者近紅外光代替紫外光作為激發光源。
( 2) 多光子激發只產生在焦點附近的一個極小區域中。單光子吸收截面 e1 = 10 — 10 cm ,雙光子吸收截面 e≈ 10 cm s /光子 ,三光子吸收截面 e ≈ 10 cm s /光子 。對於聚焦光束產生的對角錐形雷射分布,多光子激發被限制在焦點附近的一個極小區域中,從而實現“點成像”,具有固有的三維成像能力,這是多光子激發的一個基本特點。而單光子激發區域為兩個錐形區,在整個照明區均產生螢光。
多光子激發成像技術特點
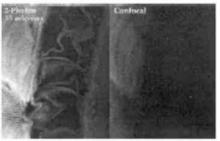 雙光子與共聚焦成像比較
雙光子與共聚焦成像比較Periasamy 和 Skoglund 等比較了相同光學配置下,雙光子雷射掃描顯微鏡和共聚焦掃描顯微鏡 對非洲蟾蜍囊胚以及神經軸胚體細胞的成像能力。 研究結果表明,雙光子激發成像穿透深度大、受細胞的固有螢光影響小。 因而 ,雙光子提供了研究細胞內動力學、物質空間分布及結構的最佳方法。與螢光顯微鏡、共聚焦顯微鏡相比,多光子雷射掃描顯微鏡具有以下特點:
(1) 對生物樣品的光損傷小。克服了共聚焦顯微鏡在活體細胞和組織觀測中的主要缺陷,減少了焦點外的光學傷害和背景光強度,極大地降低了紫外光對生物體正常生理活動的破壞和影響,為活體觀測和研究提供了有利條件。
(2) 有效觀測時間長。 螢光染料的光致漂白(即染料分子會因激發次數過多結構受到破壞而失效)是制約實驗觀測、影響實驗結果準確性的主要因素之一。對於共聚焦顯微鏡,由於整個雷射照射區域內的染料分子都會被激發 ,導致非焦點區域的染料過早漂白。 而雙光子激發只產生在焦點附近的一個極小區域中,從而大大減少了對非觀測區螢光染料的破壞 ,使實驗能夠在保持生物體活性的前提下長時間進行。
(3) 穿透深度深。生物體 (細胞、組織等)一般都是高散射體。 由於散射係數反比於入射光波長的四次方,多 (N )光子成像將散射係數減弱到原來的 1 /N ,使大部分入射光強能到達樣品焦平面 ,提高了穿透深度,有利於獲取深層次組織的清晰螢光圖像。
(4) 螢光收集率高。 與共聚焦成像相比,雙光子成像不需要光學濾波器 (針孔 ) ,提高了螢光收集率。收集效率提高直接導致圖像對比度提高。 而共聚焦顯微鏡受到小孔限制 ,如果想提高收集效率,就需要擴大孔寬度,而這將導致解析度下降,反之亦然。
(5) 對探測光路的要求低。由於激發光與發射螢光的波長差值加大以及自發的三維濾波效果,多光子顯微鏡對光路收集系統的要求比共聚焦顯微鏡低得多,光學系統相對簡單。
(6) 適合多標記複合測量。許多染料螢光探針的多光子激發光譜要比單光子激發譜寬闊,這樣,可以利用單一波長的激發光同時激發多種染料,從而得到同一生命現象中的不同信息,便於相互對照、補充。 例如, EGFP和 DsRed 的單光子激發波長分別為 488 nm和 568 nm,無法實現利用一束單波長雷射同時激發。 Jakobs等利用雙光子技術,用 925 nm雷射同時激發了兩種螢光蛋白,觀察了它們在Escherichia coli 內的表達情況。
多光子激發掃描系統的局限
目前,由於多光子技術的發展時間短,技術本身也存在一些局限。
(1)只能對螢光成像;
(2)由於紅外和近紅外光源的使用,樣品可能受到熱損傷;
(3)解析度略有降低;
(4) 受昂貴的超快雷射器限制,目前多光子掃描顯微鏡的成本較高。
多光子技術的套用研究進展
多光子雷射掃描顯微鏡是在雷射共聚焦掃描顯微鏡基礎上發展起來的。繼 1997年伯樂公司推出了第一台雙光子雷射掃描顯微鏡後,1998年 5月德國萊卡公司也加入競爭。 多光子掃描顯微鏡具有成像穿透深度深、光學三維解析度高等特點,為實時、原位觀察生物活體提供了最佳方法。
鈣生物學研究
與螢光探針技術相結合 ,多光子顯微鏡可以對細胞內的鈣離子動態過程進行實時監測、對鈣離子濃度進行準確測量。 多光子可以實現鈣離子探針與其他螢光染料的複合測量 ,研究鈣波、鈣振盪現象同其他信號轉導過程的聯繫 ,使對鈣信號的研究從亞細胞層次深入到分子水平。
神經學研究
在神經學研究中,Rose等首次用雙光子激發對海馬趾神經刺和錐狀神經樹中鈉離子進行了瞬時動態測量. Cox用雙光子顯微鏡證明了動作電位能夠影響神經軸,導致能夠引起神經遞質釋放和目標神經突觸激活的鈣離子內流。
胚胎學與組織學研究
胚胎髮育本身包含複雜的生命信息,對外界條件十分敏感。共聚焦顯微成像往往妨礙胚胎髮育,不能得到胚胎正常發育的信息。 多光子成像非常適合胚胎髮育的長期動態跟蹤。
分子生物學研究
利用某些報告基因,多光子成像可以在不破碎細胞前提下顯示基因在生物體內的表達,已廣泛套用於基因轉染和表達研究。
代謝過程研究
多光子技術可以用來對標記物質的代謝過程進行監測,記錄代謝物的分布、代謝速度,從而突破傳統的生物化學分析方法,從單個細胞層次實時研究代謝過程,已套用於藥物、糖類等物質的代謝研究。
籠鎖化合物的定點釋放
許多重要的生物物質都有其籠鎖化合物。 處於籠鎖化合物狀態的生物物質功能被封閉;特定波長的光可以使其光解籠鎖,恢復活性和功能;人為的控制籠鎖化合物的定點、定時釋放 ,便於研究生物物質的代謝過程 ,並根據治療、發育的要求進行人工操控。
對生物體內某些物質的定點操控
除了對籠鎖化合物釋放的控制,多光子技術可以方便地用於對細胞或者組織 內某些物質的定點操控。
展望
目前,多光子技術的研究主要以雙光子技術 為主。與雙光子激發相比 ,三光子激發更能體現出多光子成像的優勢。1997年, Webb等已經實現了三光子激發對小鼠活體內的血液複合胺成像。改善成像質量、提高成像速度是多光子技術發展的方向之一。 同時,尋找和製造更適合多光子激發使用的光聚合體 、大吸收截面的螢光探針技術,將為多光子技術開拓更為廣闊的發展前景。 利用納米晶體半導體量子點和表面改性技術生產的半導體螢光探針具有極其優良的光譜特徵和光化學穩定性,在多光子技術的套用中具有廣闊的發展前景。
