定義
分子中含有兩個或兩個以上的可電離的H+的弱酸都是多元弱酸,多元弱酸是屬於弱電解質。
根據酸中所含的可電離氫離子的數目,可以將酸分為一元酸(如HCl、CHCOOH)、二元酸(如HSO、HCO、HS)、三元酸(如HPO)。其中,HCl為一元強酸,HSO雖然可以電離兩個氫離子,但是是強酸,不屬於多元弱酸,CHCOOH為一元弱酸。
多元弱酸電離
多元弱酸在水中的電離是分步進行的。以磷酸為例介紹
磷酸是三元弱酸,分三步解離。
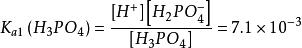 多元弱酸
多元弱酸第一步解離:HPO⇌ H + HPO
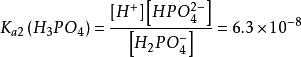 多元弱酸
多元弱酸第二步解離:HPO ⇌ H + HPO
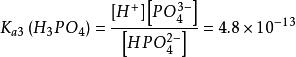 多元弱酸
多元弱酸第三步解離:HPO ⇌ H + PO
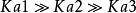 多元弱酸
多元弱酸多元弱酸的電離常數都是 ,一般相差10 ~10 。這是由於第二步解離需從帶有一個負電荷的離子中再解離出一個H ,這當然比從中性分子解離出一個H 困難的多;此外,第一步解離出的H 將抑制第二步的解離。同理第三步比第二步更困難。因此,從數量上看,由第二三步解離出的H 與第一步解離相比是微不足道的,故在計算多元弱酸溶液中H 濃度時,只需要考慮第一步解離,可當做一元弱酸來處理。當對多元弱酸的相對強弱比較時,只需比較其一級解離常數即可。
多元弱酸的酸度計算
多元弱酸在溶液中逐級離解,溶液是一個複雜的酸鹼平衡體系。以二元弱酸(HA)為例,設其濃度為c mol/L,解離常數分別為K和K。
1. 質子條件式 [H+] = [HA-] + [A2-] + [OH-] ,將有關平衡常數代入,並整理後得到計算[H+] 的精確式:
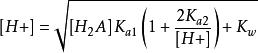 多元弱酸
多元弱酸2. 計算[H+]的近似式和最簡式
(1) 當cK≥ 20 K時,上式中的K項可忽略。
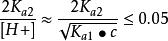 多元弱酸
多元弱酸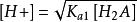 多元弱酸
多元弱酸(2) 當,可將其略去,即第二步解離也可忽略,得。而[HA] ≈ c - [H+],代入整理得到二元弱酸中H+濃度的近似式:
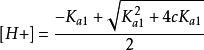 多元弱酸
多元弱酸實際上是忽略了二級解離,將二元弱酸按照一元弱酸處理。一般多元弱酸,只要濃度不太小,各步解離常數差別不太小,均可按一元弱酸處理。
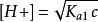 多元弱酸
多元弱酸(3)當c/K ≥ 500時,而[HA] ≈ c - [H+] ≈ c,得計算二元弱酸溶液中[H+]濃度的最簡式:。

