單分子反應詞典釋義
1.【化】monomolecularreaction;unimolecularreaction2.【醫】monomolecularreaction;unimolecularreaction
定義
反應機理之一,其特點是在決定反應速率的步驟中僅涉及一個反應物分子的變化。例如,在親核取代反應過程中,第一個步驟是離去基團與中心碳原子之間的鍵異裂(見異裂反應),生成一個不穩定的正碳離子,這是一個慢步驟;第二個步驟是正碳離子中間體迅速與親核試劑Nu:(或Nu:-)結合,構成新鍵。
詳解
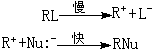
整個反應速率只決定於第一個慢的步驟。由於在決定反應速率的慢步驟中只有一個反應物(RL)分子參加,所以一般把按這種過程進行的反應叫做單分子親核取代反應SN1(S代表取代,N代表親核,1代表單分子)。
在單分子親核取代反應過程中,離解速率取決於離解後所生成的正碳離子中間體的穩定性,它是決定整個反應速率的步驟。而被離解出來的正碳離子中間體與親核試劑的結合成鍵,是不決定反應速率的步驟。反應速率只與反應物濃度成正比,而與親核試劑的濃度無關:
反應速率=k1【RL】
k1為反應速率常數。例如,用三級鹵代烴在極性較強的溶劑中與鹼反應: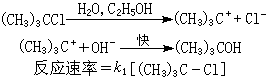
反應中間體(CH3)3C+的穩定性是單分子反應的內在因素。極性較大的溶劑具有較大的介電能力,能促進RL離解成R+和L-,是單分子反應的外部條件。
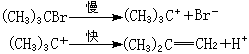
在離子型消除反應中,在溶劑的影響下,離去基團先帶著一對電子離去,生成的正碳離子失去一個質子,生成烯鍵:
參考書目
王積濤編:《高等有機化學》,人民教育出版社,北京,1980。單分子反應理論
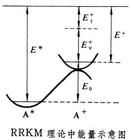
單分子反應是只有單一反應物分子參與而實現的反應。現在得知,真正的單分子反應只包括在氣相中單一反應物分子的解離與異構化。在有機化學中,存在著許多具有重要意義的異構化反應。此外,許多複合反應的關鍵步驟也是單分子反應。研究單分子反應,並從理論上探討其動力學規律是具有重要意義的。 在單分子反應的早期研究中,發現反應速率常數隨溫度的升高而增大。同時又發現許多以多原子分子為反應物的氣相單分子反應在壓力較高時是一級反應;當壓力逐漸降低時,一級反應速率常數也逐漸減小;而當壓力足夠低時,轉化為二級反應。當時,探討單分子反應理論的焦點集中在下面的問題上:既然單分子反應是由單一的反應物分子參與而實現的,似乎應該排除分子由於碰撞交換能量而獲得活化能的可能性。林德曼理論
上面所介紹的碰撞理論和過渡態理論在用到雙分子反應和三分子反應時,沒有出現什麼原則性的困難,問題在於如何回答早期研究單分子反應動力學的一個難題-單分子反應的活化能的來源問題。因此,1918年,佩蘭(PerrinJ)提出輻射論,認為分子從器壁的輻射獲得能量,但並沒有得到任何實驗的支持。1921年克利斯坦森(Christiansen)提出碰撞激發的概念。1922年林德曼(Lindermann)提出了單分子熱反應機理的時滯理論,解釋了實驗所得的結果。早期的實驗研究表明,在高壓下,單分子反應服從一級反應動力學。此外,還發現,當反應物壓力降低時,一級速率常數也減小,而在極低壓力時,反應就變成二級反應。結果如圖9-10所示。林德曼用時滯理論定性地解釋了這一實驗現象。他假設存在著臨界內能Ec(主要是振動能),通過雙分子熱碰撞使一部分反應物分子A獲得比Ec多的能量而成為激發分子或富能分子A*。如果反應物A是一個複雜的多原子分子,則當A或者A*與另一個分子M發生非彈性碰撞時,其間有個"時滯期",而在此時滯期內,M可以把能量傳遞給A或者從A*把能量傳遞出去,而M可以是被加入的惰性氣體或A本身。前者為A分子的活化過程,而後者為A*分子的失活過程。受激分子A*以一種與能量傳遞速率不相上下的有限速率生成產物P。
1.當壓力或濃度很高時,即k-1·[M]》k2時,
此時反應為一級。
2.當壓力或濃度非常低的低壓極限下,可以認為k-1·[M]《k2,則
ku=k1[M]
r=k1[M][A](9-92)
如果沒有其它氣體加入,則[M]=[A],所以低壓時反應為二級。
3.在高壓極限和低壓極限之間,反應沒有簡單級數[見式(9-92)],ku隨M的減少而減小;同時,反應級數也從高壓極限時的一級向低壓極限時的二級過渡。這種現象稱為準單分子反應速率的"降變"。用ku對[M]作圖得出圖9-10中所示的曲線,它表明在高壓區,
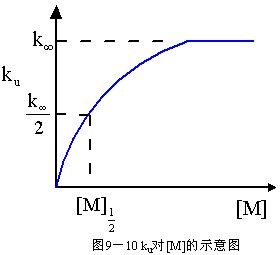 圖9-10
圖9-10ku是常數,在低壓區則一直降低到零。下降區域一般是以ku/k∞=1/2時所對應的壓力或濃度[M]1/2來表征的。由式(9-96),當ku/k∞=1/2時,[M]1/2=k2/k-1結合式(9-94),得[M]1/2=k∞/k1式中k∞和[M]1/2可由實驗測定,因此k1可由實驗數據算得。
但是,林德曼理論在定量上尚有欠缺:
1.如果合理地假設:所有實驗測得的k∞中的活化能都屬於k1的,而k-1和k2的活化能為零,則利用簡單碰撞理論公式(9-17)可計算k1。結果表明,該計算值與由式(9-97)得到的k1實驗值相差很大,且分子越大,不一致性越大
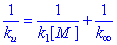 9-98
9-98用1/ku對1/[M]作圖,應得一直線。然而,實驗上發現高壓區實驗結果顯著偏離線性,如圖9-11所示。
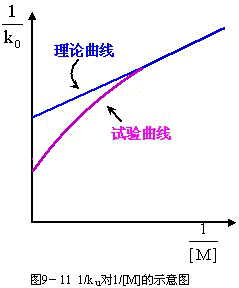 圖9-11
圖9-11