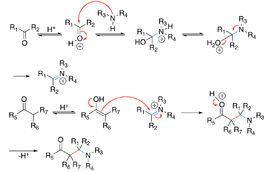
任務和目的
將化學反應套用於生產實踐主要有兩個方面的問題:一是要了解反應進行的方向和最大限度以及外界條件對平衡的影響;二是要知道反應進行的速率和反應的歷程(機理)。人們把前者歸為化學熱力學的研究範圍,把後者歸為化學動力學(chemical kinetics)的研究範圍。
化學動力學的基本任務之一是了解反應的速率,了解各因素(如分子結構、溫度、壓力、濃度、介質、催化劑等)對反應速率的影響,從而給人們提供選擇反應條件、掌握控制反應進行的主動權,使化學反應按我們所希望的速率進行。
化學動力學的另一個基本任務是研究反應歷程(mechanism)。反應歷程試圖描述化學反應每個過程中的所發生的情況。然而事實上,反應的具體過程是不易觀察到的。由於在熱力學上可行,且定量和定性結果均為中間體的存在提供支持,從而採用這種推測的反應歷程具有合理性。知道了這些歷程,可以找出決定反應速率的關鍵所在,使主反應按照我們所需要的方向進行,從而指導生產 。
定義
反應歷程是化學中用來描述某一化學變化所經由的全部基元反應,就是反應物究竟按什麼途徑,經過哪些步驟得到最終產物。雖然整個化學變化所發生的物質轉變可能很明顯,但為了探明這一過程的反應機理,常常需要實驗來驗證。
舉例
三羧酸循環
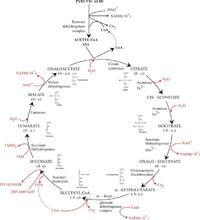 三羧酸循環
三羧酸循環三羧酸循環是一個巨觀的反應過程,每一個循環中有包含了複雜的微觀反應歷程。
檸檬酸循環(citricacidcycle):也稱為三羧酸循環(tricarboxylic acid cycle,TCA循環,TCA),Krebs循環。是用於將乙醯CoA中的乙醯基氧化成二氧化碳和還原當量的酶促反應的循環系統,該循環的第一步是由乙醯CoA與草醯乙酸縮合形成檸檬酸。反應物乙醯輔酶A(Acetyl-CoA)(一分子輔酶A和一個乙醯相連)是糖類、脂類、胺基酸代謝的共同的中間產物,進入循環後會被分解最終生成產物二氧化碳並產生H,H將傳遞給輔酶--尼克醯胺腺嘌呤二核苷酸(NAD+) 和黃素腺嘌呤二核苷酸(FAD),使之成為NADH + H 和FADH。 NADH + H 和 FADH攜帶H進入呼吸鏈,呼吸鏈將電子傳遞給O產生水,同時偶聯氧化磷酸化產生ATP,提供能量。
乙烷熱分解
乙烷的熱分解反應在823~923K之間,反應方程式可以寫作:
CH(g)→CH(g)+H(g)
根據質譜儀和其他實驗手段證明,在乙烷的分解過程中有自由基CH·和CH·生成,有人認為該反應是按下列的鏈式反應機理進行的:
(1)CH→2CH·
(2)CH·+CH→CH+CH·
(3)CH·→CH+H·
(4)H·+CH→H+CH·
(5)H·+CH·→CH
研究意義
研究反應歷程對構建精確的反應模型十分重要。此外,了解反應歷程可以幫助我們了解物質結構的知識,因為化學變化從根本上來說,就是舊鍵的破裂和新鍵的生成。反應的歷程能夠反映出物質結構和反應能力之間的關係,從而可以加深我們對於物質運動形態的認識。當然,用已知的物質結構的知識也可以推測一些反應的歷程,然而遺憾的是迄今為止,真正弄清楚反應歷程的反應為數還不多,這方面的工作遠遠落後於實際。但是隨著各種新型譜儀的出現和用雷射、交叉分子束等實驗手段對微觀反應動力學的研究越來越深入,人們對反應機理的研究已經達到一個新的高度 。