警示語
【禁忌】本品禁用於對加替沙星或喹諾酮類藥物過敏者。糖尿病患者謹遵醫囑、慎用。
【警告】血糖異常
已有報導加替沙星引起的血糖異常,包括症狀性低血糖症和高血糖症。這些事件通常在糖尿病患者中發生。但是,低血糖症,特別是高血糖症已經在沒有糖尿病病史的患者中產生。除了糖尿病以外,服用加替沙星時與血糖代謝異常相關的其他危險因素包括老年患者、腎功能不全、影響葡萄糖代謝的合併用藥(特別是降血糖用藥)。具有這些危險因素的患者應該密切監控血糖。如果用加替沙星治療的任何患者發生低血糖或者高血糖的症狀和體徵,必須立刻進行適當的治療,並應該停用加替沙星。
已有報導血糖的暫時異常,通常包括開始治療3天內血清胰島素水平升高和血糖水平降低,有時導致嚴重低血糖症。也已經觀察到了高血糖症,甚至某些病例為嚴重高血糖症。高血糖症通常在套用加替沙星第3天后發生。
在加替沙星上市後,已有報導套用加替沙星治療的患者中極少數出現嚴重血糖異常。這些異常包括高滲性非酮症高血糖昏迷、糖尿病酮症酸中毒、低血糖昏迷、痙攣和精神狀態改變(包括意識喪失)。雖然少數導致致死後果,但是如果得到適當處理,這些事件中大多數是可逆的。
成份
本品主要成分為加替沙星,化學名稱:1-環丙基-6-氟-1,4-二氫-8-甲氧基-7-(3-甲基-1-哌嗪基)-4-氧代-3-喹啉羧酸。
化學結構式:
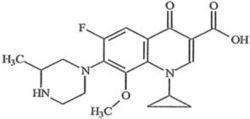 加替沙星眼用凝膠
加替沙星眼用凝膠分子式:CHFNO
分子量:375.40
性狀
本品為無色至淡黃色透明狀凝膠。
適應症
本品適用於敏感菌所引起的急性細菌性結膜炎。
規格
0.3%。
用法用量
每次1滴,每天3次。
不良反應
眼部用藥常見的不良反應為結膜刺激、流淚、角膜炎和乳頭狀結膜炎,發生率約為5-10%。發生率在1-4%的不良反應為球結膜水腫、結膜充血、眼乾、流淚、眼部刺激、眼部疼痛、眼瞼水腫、頭痛、紅眼、視力減退和味覺混亂。
禁忌
本品禁用於對加替沙星或喹諾酮類藥物過敏者。糖尿病患者謹遵醫囑、慎用。
注意事項
1.本品只限於滴眼用,不能結膜下注射使用,也不能直接注入眼前節。
2.包括加替沙星是在內的喹諾酮類藥物全身給藥(如口服和靜脈給藥)偶爾可出現嚴重的不良反應,有些患者在第一次用藥後出現。一些反應伴隨著心衰、意識喪失、血管性水腫(包括喉頭、咽、面部水腫)、氣管梗阻、呼吸困難、蕁麻疹、瘙癢。出現過敏症狀,立即停藥。
3.避免使用接觸鏡,避免眼睛、手指和其他物品污染容器瓶口。
4.像其他抗生素一樣,長期套用可能導致非敏感菌如真菌的過度生長,如出現二重感染應停止使用本品,改變治療。
5.本品開啟後最多可使用四周。
孕婦及哺乳期婦女用藥
大鼠和家兔口服50mg/Kg/日加替沙星未發現致畸作用。而大鼠口服150mg/Kg/日可導致胎鼠骨骼/顱面畸形或延遲骨化、前房肥大、體重減輕。圍產期口服200mg/Kg/日,出現流產、胎鼠圍產期死亡率增加。由於缺乏妊娠婦女使用加替沙星的研究資料,孕婦使用本品應諮詢醫生,權衡利弊後方可使用。加替沙星能在大鼠的乳汁中分泌,是否經人乳汁中分泌尚不清楚,哺乳期婦女應慎重。
兒童用藥
1歲以下嬰兒使用本品的安全性和有效性尚未建立,嬰兒慎用。
老年用藥
老年患者和年輕患者使用加替沙星的有效性和安全性未見顯著不同。
藥物相互作用
加替沙星眼用凝膠與其他藥物的相互作用尚不明確。然而,全身給予喹諾酮類抗生素能引起茶鹼血漿藥物濃度升高,影響咖啡因的代謝,增強口服抗凝藥華法林及其衍生物的療效,引起服用環孢素的患者的血漿肌苷水平一過性增加,與上述藥物合用時請遵醫囑。
藥物過量
尚不明確。
臨床試驗
經浙江大學醫學院附屬第一醫院、首都醫科大學附屬北京同仁醫院等5家臨床試驗藥理基地,對240例受試者的臨床研究證明,0.3%加替沙星眼用凝膠對急性或亞急性細菌性結膜炎有較好的治療效果,能夠有效的清除引起細菌性結膜炎的各種致病菌,並具有良好的安全性和耐受性。
藥理毒理
藥理作用
加替沙星為8-甲氧基氟喹諾酮類外消旋體化合物,體外具有廣譜的抗革蘭氏陰性和陽性微生物的活性,其R-和S-對映體抗菌活性相同。本品的抗菌作用是通過抑制細菌的DNA旋轉酶和拓撲異構酶Ⅳ,從而抑制細菌DNA的複製,轉錄、修復過程。
體外實驗和臨床使用結果均表明,本品對以下微生物的大多數菌株具抗菌活性:
1、革蘭氏陽性菌:金黃色葡萄球菌(僅限於對甲氧西林敏感的菌株)、凝固酶陰性葡萄球菌屬、肺炎鏈球菌等鏈球菌屬菌株。
2、革蘭氏陰性菌:嗜血桿菌屬菌(流感和副流感嗜血桿菌)、卡他莫拉菌、奈瑟菌屬菌、不動桿菌屬菌、肺炎克雷伯菌、陰溝腸桿菌、變形桿菌(奇異變形桿菌和普通變形桿菌)、銅綠假單胞菌、枸櫞酸桿菌和大腸埃希菌。
3、其他微生物:肺炎衣原體、嗜肺性軍團菌、肺炎支原體。
毒理研究
遺傳毒性:
Ames試驗中本品對多種菌株無致突變作用,但是體外對沙門氏菌株TA102有致突變作用。中國倉鼠V79細胞的基因突變和中國倉鼠CHL/IU細胞的遺傳學試驗結果均陽性。類似的結果在其他喹諾酮類的藥物也可見,這可能是由高濃度下本品對真核生物的Ⅱ型DNA拓撲異構酶的抑制作用所致。本品經口和靜脈給藥的小鼠微核試驗、大鼠經口給藥的細胞遺傳學試驗、大鼠經口給藥的DNA修複試驗結果均為陰性。
生殖毒性:
對大鼠經口給予劑量高達200mg/kg(以每日暴露量(AUC)計,與人最大推薦劑量等效),對大鼠生育力和生殖無不良反應。大鼠和家兔經口給予劑量分別達150mg/kg和50mg/kg(以AUC計,約為人最大推薦劑量的0.7和1.9倍),未見有致畸胎作用。但是大鼠在器官形成期,經口或靜脈給予劑量分別達200mg/kg和60mg/kg可引起胎仔骨骼畸形;經口或靜脈給予劑量分別≥150mg/kg和≥30mg/kg時,可引起胎仔骨骼骨化延遲,包括出現波形肋骨。提示在此劑量下,有輕度的胎仔毒性。此毒性在其他的喹諾酮類藥物也可見。
大鼠在妊娠後期的最初階段經口給藥劑量達200mg/kg,並持續給藥至哺乳期,可見後期的植入後胚胎丟失增加和新生仔和圍產期的死亡率升高。這些發現提示了本品的胎仔毒性。
致癌性:
B6C3F1小鼠經摻食給藥18月,雌、雄動物劑量分別為90mg/kg和81mg/kg[以每天全身暴露量(AUC)計,約為人最大推薦劑量的0.13和0.18倍];Fischer344大鼠經摻食給藥2年,雌、雄動物劑量分別為139mg/kg和47mg/kg(以AUC計,約為人最大推薦劑量的0.81和0.36倍),結果均未提示本品有促進腫瘤生長的作用,但是雄性動物當劑量達100mg/kg(以AUC計,約為人最大推薦劑量的0.74倍)時,與對照組相比,可增加巨粒細胞淋巴(LGL)白血病的發病率,儘管這種增加稍高於已有歷史性對照的範圍,但是並不能認為雄性動物高劑量下的這些發現會影響到本品臨床用藥的安全性。
藥代動力學
經兔眼單次給予0.3%加替沙星眼用凝膠研究結果表明,眼用凝膠在淚液中的T1/2為157min,達峰濃度為1864.85mg/g,在0-360min時的AUC0-360為34313.07((mg/g)*min);在角膜中的T1/2為106min,達峰濃度為30.63mg/g,在0-360min時的AUC0-360為2893.6((mg/g)*min);在房水中T1/2為72.58min,達峰濃度為2.39mg/ml,在0-360min時房水中的AUC0-360為348.33((mg/ml)*min)。加替沙星眼用凝膠對兔眼單次給藥後在淚液、角膜和房水中的經時過程,說明加替沙星眼用凝膠單次給藥可以顯著提高眼部的生物利用度,增加在淚液、角膜和房水中的藥物濃度,增加加替沙星眼用凝膠在眼部駐留時間和抗菌作用。
貯藏
密閉,常溫保存。
包裝
藥用軟膏鋁管;5g/支。
有效期
24個月。
執行標準
國家食品藥品監督管理局標準YBH03692009