簡介
將正、負電荷中心間的距離 d和電荷中心所帶電量 q的乘積,叫做電偶極矩(dipole moment),簡稱電矩,數學表達式為 μ= q d。它是一個矢量,方向規定為從正電中心指向負電中心。偶極矩的單位是D(德拜)。根據討論的對象不同,偶極矩可以指鍵電偶極矩,也可以是分子電偶極矩(分子電矩)。分子電矩可由鍵電偶極矩經矢量加法後得到。實驗測得的分子電矩可以用來判斷分子的空間構型。
基本介紹
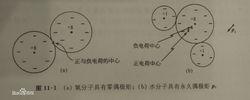
同屬於AB型分子,二氧化碳(CO)的 μ=0,可判斷它是直線型的;硫化氫(HS)的 μ≠0,可判斷它是折線型的。可以用電偶極矩表示極性大小。鍵電偶極矩越大,表示鍵的極性越大;分子的電偶極矩越大,表示分子的極性越大。
分析說明
兩個電荷中,一個電荷的電量與這兩個電荷間的距離的乘積。可用以表示一個分子中極性的大小。如果一個分子中的正電荷與負電荷排列不對稱,就會引起電性不對稱,因而分子的一部分有較顯著的陽性,另一部分有較顯著的陰性。這些分子能互相吸引而成較大的分子。例如締合分子的形成,大部分是由於氫鍵,小部分就是由於電矩。
分子電偶極矩測定
偶極矩與極化度
分子呈電中性,但因空間構型的不同,正負電荷中心可能重合,也可能不重合。前者稱為非極性分子,後者稱為極性分子,分子極性大小用偶極矩μ來度量,偶極矩定義為:
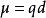 分子電矩
分子電矩式中, q為正、負電荷中心所帶的電荷量; d是正、負電荷中心間的距離。偶極矩的SI單位是庫侖·米(C·m)。
若將極性分子置於均勻的外電場中,分子將沿電場方向轉動,同時還會發生電子云對分子骨架的相對移動和分子骨架的變形,稱為極化。極化的程度用摩爾極化度 P來度量。 P是轉向極化度 P、電子極化度 P與原子極化度 P之和: P= P+ P+ P……
由於 P在 P中所占的比例很小,所以在不很精確的測量中可以忽略 P,則上式可寫成: P= P向+ P。只要在低頻電場 V或靜電場中測得 P;在 V的高頻電場(紫外可見光)中,由於極性分子的轉向和分子骨架變形跟不上電場的變化,故 P=0。
P=0,所以測得的是 P。這樣可求得 P,再計算 μ。
通過測定分子電矩,可以了解分子中電子云的分布和分子對稱性,判斷幾何異構體和分子的立體結構。
溶液法測定偶極矩
所謂溶液法就是將極性待測物溶於非極性溶劑中進行測定,然後外推到無限稀釋。
本實驗是將正丁醇溶於非極性的環己烷中形成稀溶液,然後在低頻電場中測量溶液的介電常數和溶液的密度求得摩爾極化度;在可見光下測定溶液的摩爾折射度,然後計算正丁醇的偶極矩。
實驗裝置如右圖:左邊是精密電容測量儀,中間是電容池,右邊是阿貝折射儀。
 分子電矩
分子電矩