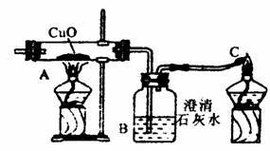
實驗器材
鐵架台、酒精燈(也可以是酒精噴燈)、試管、導管、雙孔橡皮塞、單孔橡皮塞。
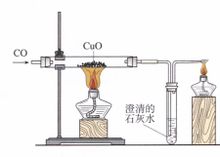 一氧化碳還原氧化銅
一氧化碳還原氧化銅藥品有:氧化銅、澄清石灰水、一氧化碳
化學反應
CO與CuO反應的化學方程式為:
CuO + CO ==△==Cu + CO2 一氧化碳還原氧化銅還可能生成中間產物 氧化亞銅 Cu2O
註:該反應類型屬於氧化還原反應
CO2與Ca(OH)2(澄清石灰水)反應的化學方程式:
Ca(OH)2 + CO2 = CaCO3↓+ H2O
反應現象
①黑色固體變成亮紅色 ②導管口有氣泡冒出 ③澄清石灰水變渾濁
實驗步驟
1.連線裝置
2.檢查裝置的氣密性。
3.點燃加熱尾氣的酒精燈。
4.通入CO,排除串聯裝置中的空氣,防止爆炸。
5.加熱CuO。
6.停止加熱CuO。
7.通入CO,排淨殘留在串聯裝置中的空氣。
8.停止點燃尾氣。
注:①先通入CO一會兒 ,是為了排盡玻璃管內的空氣,防止一氧化碳和氧氣混合加熱發生爆炸。
②繼續通入CO到玻璃管冷卻為止,是為了防止石灰水倒流進玻璃管中(這裡不會被氧化是因為玻璃管內沒有氧氣的存在)
總之:"CO早出晚歸,酒精燈遲到早退"③用酒精燈點燃是進行尾氣處理:防止一氧化碳污染空氣,使人中毒。
註:此試驗 應在通風櫥中進行:防止沒除淨的CO使人中毒。
CO性質
物理性質
在通常狀況下,一氧化碳是無色、無臭、無味、有毒的氣體,熔點—199℃,沸點—191.5℃。標準狀況下氣體密度為l.25g/L,和空氣密度(標準狀況下1.293g/L相差很小,這也是容易發生煤氣中毒的因素之一。它為中性氣體。
分子結構:一氧化碳分子為極性分子,分子形狀為直線形。
化學性質
一氧化碳分子中碳元素的化合價是十2,能進一步被氧化成+4價,從而使一氧化碳具有可燃性和還原性,一氧化碳能夠在空氣中或氧氣中燃燒,生成二氧化碳:2CO+O2=點燃=2CO2(CO2轉化成CO,化學方程式:CO2+C=高溫=2CO)
一氧化碳的成鍵方法:C和O化合時,C的p軌道2個電子和O的p軌道未成對的2個電子形成2個共用電子對,然後,C的p軌道上還有一個空軌道,O的p軌道上還有一對孤對電子,形成第3個共用電子對(這是一個配位鍵),最終形成的是碳氧三鍵。
燃燒時發出淡藍的火焰,放出大量的熱。因此一氧化碳可以作為氣體燃料。
一氧化碳作為還原劑,高溫時能將許多金屬氧化物還原成金屬單質,因此常用於金屬的冶煉。如:將黑色的氧化銅還原成紅色的金屬銅,將氧化鋅還原成金屬鋅,將氧化鐵和四氧化三鐵還原為金屬鐵。