δ鍵簡介
從鍵軸看去,δ鍵的軌道對稱性與d軌道的沒有區別,而希臘字母δ也正來源於d軌道。
 δ鍵形成示意圖
δ鍵形成示意圖 δ鍵常出現在有機金屬化合物中,尤其是釕、鉬和錸所形成的化合物。教科書中常以ReCl 離子中的四重鍵來介紹δ鍵,而這四重鍵中包含1個σ鍵、2個π鍵和1個δ鍵。以通俗的話講,σ鍵是“頭碰頭”,π鍵是“肩並肩”,而δ鍵則是“面對面”。理論上,由於π反鍵軌道與δ鍵的對稱性一致,因此從乙炔能量低的非鍵軌道中激發電子,使得在碳碳叄鍵上再形成一個δ鍵是可能的。
從δ鍵可以推出涉及f和g軌道的可能新鍵型:φ鍵和γ鍵,它們涉及到原子軌道更多重瓣的重疊。但目前還沒有觀測到這些鍵。
δ鍵的形成
1、δ鍵是原子軌道沿軸力方向重疊而形成的,具有較大的重疊程度,因此δ鍵比較穩定。δ鍵是能圍繞對稱軸旋轉,而不影響鍵的強度以及鍵跟鍵之間的角度(鍵角)。
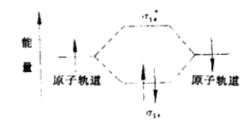 分子軌道
分子軌道 2、根據分子軌道理論,兩個原子軌道充分接近後,能通過原子軌道的線性組台,形成兩個分子軌道。其中,能量低於原來原子軌道的分子軌道叫成鍵軌道,能量高於原來原子軌道的分子軌道叫反鍵軌道。以核間軸為對稱軸的成鍵軌道叫δ軌道,相對應的鍵叫δ鍵;以核間軸為對稱軸的反鍵軌道叫δˊ鍵軌道,對應的鍵叫δˊ鍵。分子在基態時,構成化學鍵的電子通常處在成鍵軌道中,而讓反鍵軌道空著。如下圖。
σ鍵和π鍵的比較
| 鍵類型 | 鍵 | π鍵 |
| 原子軌道重疊方式 | 沿鍵軸方向相對重疊 | 沿鍵軸方向平行重疊 |
| 原子軌道重疊部位 | 兩原子核之間,在鍵軸上 | 鍵軸上方和下方,鍵軸處為零 |
| 原子軌道重疊程度 | 大 | 小 |
| 鍵的強度 | 較大 | 較小 |
| 化學活潑性 | 不活潑 | 活潑 |
成鍵規律:共價單鍵是σ鍵;雙鍵中有一個是σ鍵,一個π鍵;三鍵中有一個是σ鍵,兩個π鍵。
δ軌道和δ鍵
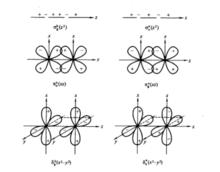
當電子在占軌道上運動時其角動量沿鍵軸的分量為2個原子單位,而δ 軌道的形狀則需從它是由什麼軌道構成的來考慮。前面討論過的σ和π軌道可以分別由s軌道或p軌道來構成,也可以用s軌道和p軌道構成δ軌道或p軌道和p軌道構成π軌道。但δ軌道構成時則必須由d軌道和d軌道相互靠攏來形成(見下圖)。
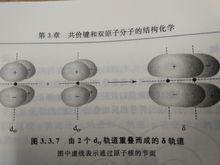
 由3d軌道形成6種不同分子軌道的情況
由3d軌道形成6種不同分子軌道的情況 當2個d或2個d軌道相互沿著z軸(鍵軸)靠攏時就形成了δ軌道。在圖中σ(z ),σ(z )分別表示由2個d軌道形成的σ成鍵和反鍵軌道,π(xz),π(xz)分別表示由2個d軌道沿鍵軸相互靠攏形成的π成鍵和π反鍵軌道,而δ(z 一y ),δ(z 一y )分別表示由2個d 軌道沿鍵軸相互靠攏形成的δ成鍵和反鍵軌道。在δ軌道運動的電子就是δ電子,由δ電子形成的共價鍵就是δ鍵。
用途
兩個原子軌道重疊時,重疊程度越大,形成的共價鍵越穩定,δ鍵是原子軌道沿軸向重疊的,所以具有較大重疊程度,比較穩定、鍵能較大,δ鍵不容易極化,可以單獨存在。
