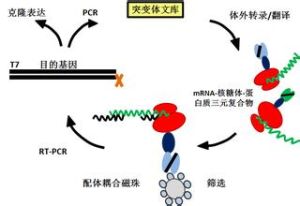
原理
核糖體展示技術通過聚合酶鏈反應(PCR)擴增DNA文庫,同時引入T7啟動子、核糖體結合位點及莖-環結構,將其轉錄成mRNA,在無細胞翻譯系統中進行翻譯,使目的基因的翻譯產物展示在核糖體表面,形成“mRNA-核糖體-蛋白質”複合物,構成核糖體展示的蛋白文庫,然後用相應的抗原從翻譯混合物中進行篩選,以乙二胺四乙酸(EDTA)解離結合的核糖體複合物或以特異抗原洗脫整個複合物,並從中分離mRNA。通過反轉錄聚合酶鏈反應(RT-PCR)提供下一輪展示的模板,所得DNA進入下一輪富集,部分DNA可通過克隆進行測序分析等。Kawasaki曾建議採用類似的途徑從肽庫中篩選多肽配體。在此之前,利用前期多肽抗體進行免疫沉澱,已經分離到了與核糖體和多肽偶聯的mRNA。Mattheakis等人首次將前人的構想付諸實踐,建立了篩選多肽類配體的多聚核糖體展示技術,並從一個庫容為10^12的肽庫中,篩選到親和力常數達到10^9(nmol級)的固定化單抗的多肽配體。Gersuk等人利用該技術也篩選到前列腺癌腫瘤標記的多肽配體。體外翻譯時,蛋白或多肽的摺疊與翻譯同步進行u。與核糖體結合的天然多肽也具有酶活性。這些研究結果說明,如果某種蛋白質的摺疊不受核糖體蛋白通道的影響,那么與核糖體的解離就不是該蛋白獲得天然構像的必要條件。1997年,Plückthun實驗室在以上研究成果的基礎上,對Mattheakis的多聚核糖體展示技術進行了改進,建立了體外篩選完整功能蛋白(如抗體)的新技術:核糖體展示技術。
步驟
基因片段的改造
 核糖體轉化
核糖體轉化①分別將需要的基因片段和間隔序列各自擴出來。
②用引物4和引物5做連線PCR將目的基因和間隔子連線起來,引物5含有SD序列,引物4含有3′端莖環結構序列。
③PCR產物再進行延伸PCR,引物6含有T7啟動子序列和5′端莖環結構序列,下游產物同前。最後得到的PCR產物,5′端接上T7啟動子和莖環結構以及SD序列,3′端則融合了間隔序列並含有3′端的莖環結構。
體外轉錄和翻譯
1)體外表達可以利用來自原核的E.coliS30無細胞蛋白質合成系統,或真核的兔網織紅細胞裂解液和麥胚提取物的蛋白質合成系統,至於何種系統更適合,目前尚有爭議.體外轉錄與體外翻譯可以偶聯進行,也可以分別進行.目前,已有以DNA為模板的體外蛋白翻譯系統和以RNA為模板的體外轉錄與翻譯偶聯的商用系統問世。對於含二硫橋的ScFv抗體和其他蛋白質,轉錄和翻譯應分別進行,因為含有二硫橋的蛋白質要在氧化條件下才能正確摺疊,但轉錄時,T7RNA聚合酶要求具還原性的β-巰基乙醇維持其穩定性。如果目標蛋白在還原性條件下能正確摺疊,則體外轉錄/翻譯偶聯體系效果可能更好.。
2)若分別進行,則需要控制RNase的影響.VRC—過渡態類似物—作為RNase抑制劑,能有效抑制核酸酶,提高E.coli核糖體展示效率。翻譯結束後立即冷卻反應混合物,所有篩選步驟在冰上進行降低RNase的影響。另外,3′端和5′端的莖環結構也可以使mRNA避免核酸外切酶RNaseⅡ和核酸內切酶RNaseE的影響。
親和篩選
體外翻譯反應結束後,將翻譯混合物稀釋4倍終止反應。反應試劑中始終保持5mmol/LMg2+濃度,穩定mRNA-核糖體-蛋白質三元複合體。可以直接用於篩選實驗,也可以於4℃保存,核糖體複合物在4℃至少可以穩定10d,但產量會逐漸減少。體外篩選時加入1%~2%脫脂奶粉和0.2%肝素可以降低抗原-抗體的非特異性反應,肝素還能抑制核酸酶。①親和篩選
分為固相篩選和液相篩選,主要有ELISA和磁珠法。Hanes等認為,ELISA方法中,抗原包被在塑膠表面上,而塑膠表面的疏水作用有可能會影響吸附蛋白的空間構象,從而導致篩選出的抗體分子不能識別抗原的天然表位;磁珠法是在抗原上連線捕獲標籤,如生物素,然後在形成抗原-抗體複合物後,採用磁珠-鏈霉親和素捕獲該標籤,進行親和篩選。
②mRNA的分離
篩選完後,加入含20mmol/LEDTA的冰冷緩衝液洗脫mRNA。洗脫下來的mRNA用DNaseⅠ處理去除殘留的DNA模板,進行RT-PCR反應重新引入T7啟動子,SD序列等核糖體展示必需元件用於下一輪展示或直接進行Northern雜交,評價篩選效率。將最後一輪篩選到的靶標基因與質粒連線,轉化到大腸桿菌中,可以得到單個靶標克隆。進一步採用體外或體內(分泌型或包涵體型)表達方式表達單鏈抗體分子,進行活性鑑定。