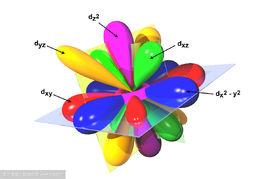
結構和形狀
d軌道從主量子數n=3開始出現,最小的d軌道是3d軌道,也就是說1d、2d軌道不存在,當角量子數為2時,其軌道為d軌道,主量子數不可小於三,對應於五個磁量子數2、1、0、-1、-2,在3d軌道中,有五個能量相同的3d軌道,同樣的,主量子數為4以上時也有五個4d軌道,因此,每個殼層都有五個d軌道。在存在的五個d軌道中,有四個形狀相同,但方向不同。4d、5d、6d軌道可視為性質與3d軌道相似,只是大小比較大,其與p軌道類似,也有“正負性”,這些“正負性”變化在原子軌道彼此形成化學鍵時非常重要。
d軌道一樣有波節面,類似於p軌道的形式,但d軌道中間的部分較特別,是一個環狀結構像外的波,但電子出現機率和s軌道相反,例如4d軌道的中間部分:在靠近原子核之處電子出現機率幾乎是0,然後開始增加,出現一個較高電子出現機率的環狀區域,但繼續向外看之後,隨即降為0,接著又增加,出現一個更大的較高電子出現機率的環狀區域,然後在距離原子核甚遠的地方又為0,而上下的雙啞鈴形的結構則與p軌道相同。
性質
d軌道有能級交錯現象。例如,3d的能量似乎應該低於4s,而實際上E>E。按能量最低原理,電子在進入核外電子層時,不是排完3p就排3d,而是先排4s,排完4s才排3d。
d軌道在半填滿和全填滿時較穩定,因此,許多過渡金屬傾向於失去d軌道的電子直到其成為半填滿為止,如鐵,原價電子組態為3d4s,失去s軌道後還會再放出1個d軌道電子,使其成為Fe,組態為:3d,此時d軌道半填滿,因此Fe較穩定,這也是為何Fe離子傾向於變成Fe離子的原因 。
d區元素
d區元素是指這些元素中具有最高能量的電子是填在d軌道上的,是元素周期表中的副族元素,即第3至第12族元素。這些元素有時也被稱作過渡金屬。在周期表中,過渡金屬的價軌道是d軌道,除了內過渡金屬,另外,除了前三周期之外,大部分的非金屬的價殼層之d軌道是填滿的 。