元素介紹
新華網莫斯科6月27日專電(記者欒海)俄羅斯杜布納核研究聯合科研所於近日再次合成了元素周期表上的第116號元素,從而確認了這一新元素的存在。 去年7月19日,該科研所的專家首次直接在加速器上合成了第116號元素。該元素存在了0.05秒後便衰變成了其它元素。據俄專家介紹,在微觀世界中第116號元素能夠存在0.05秒,實屬驚人。1995年,德國科學家首次合成的第112號元素只生存了240微秒,令人遺憾。
1999年,該科研所的專家曾在實驗室中合成了元素周期表上的第114號元素。據該所的核反應實驗室主任奧加涅相介紹,再次誕生的第116號元素能夠通過阿爾法衰變蛻變成另一種物質,其化學性質與114號元素的一種同位素完全相同。因此,116號元素的再度出現直接或間接地證明了116號和114號元素的存在。的是,在整個實驗過程中,俄專家只合成了一個116號元素的原子。為了證實該元素確實存在,必須再次合成116號元素。 據俄杜布納市市政新聞處介紹,在不久前進行的實驗中,當研究人員用鈣的同位素鈣-48的離子轟擊鋦-248時,轟擊的生成物中再次誕生了一個116號元素的原子。該原子的核電荷數為116,中子數為176。
奧加涅相指出,得到確認的第116號元素證實了“穩定島”學說中的有關論述。20世紀60年代,曾有核物理學家提出“穩定島”學說,預言在原子序數為114號的元素附近存在著超重原子核穩定區域,該區域內的原子能夠長時間地存在。俄專家認為,被驗明正身的116號元素不但證實了這一論述,而且為超重原子核化學特性和人造元素的研究開創了一個全新局面。
元素周期表
是根據原子序從小至大排序的化學元素列表。列表大體呈長方形,某些元素周期中留有空格,使特性相近的元素歸在同一族中,如鹵素及惰性氣體。這使周期表中形成元素分區。由於周期表能夠準確地預測各種元素的特性及其之間的關係,因此它在化學及其他科學範疇中被廣泛使用,作為分析化學行為時十分有用的框架。
現代的周期表由德米特里·門捷列夫於1869年創造,用以展現當時已知元素特性的周期性。自此,隨著新元素的探索發現和理論模型的發展,周期表的外觀曾經過改變及擴張。通過這種列表方式,門捷列夫也預測了一些當時未知元素的特性,以填補周期表中的空格。其後發現的新元素的確有相似的特性,使他的預測得到證實。
化學元素周期表的編號規則依據各個化學元素的原子序編撰。原子序從1(氫)至118(Uuo)的所有元素都已被成功合成,而其中直到鐦的元素都在自然界中存在,其餘的(亦包括眾多放射性同位素)都是在實驗室中合成的。目前Uuo之後的元素的合成正在進行中,帶出了如何變更成擴張周期表的問題。
發展歷史
創造
門捷列夫1869年的周期表。注意表中周期為列,族為行。
俄羅斯化學教授德米特里·門捷列夫和德國化學家尤利烏斯·洛塔爾·邁耶爾分別在1869和1870年獨立發表了他們的周期表。他們的周期表各式相似:以原子量橫向或豎向排列元素,並在元素特性重複時另開一行或一列。門捷列夫的列表的成功是由於兩點:首先他在表中留下空格,對應於還沒有發現的元素。門捷列夫並不是第一位這樣做的化學家,但他是第一位通過周期表中的趨勢預測未知元素(如鎵和鍺)的特性的人。第二,他決定有時不按原子量排序,而與相鄰的元素互換,如鈷和鎳,以此將元素依照化學族分類。隨著原子結構理論的發展,人們發現原來門捷列夫的元素是按照原子量排列的。
進一步發展
門捷列夫創造元素周期表後,化學家不斷在自然界中發現新的元素,填補當初的空格。一般認為最後一個發現的自然元素是鍅(門捷列夫稱之為eka銫),發現於1939年。然而,1940年合成的鈽在1971年被發現少量地自然產生。
隨著有關原子內電子排布的量子力學理論的發展,人們發現周期表中的每一行(周期)對應於填充一個電子殼層。在門捷列夫最初的周期表中,每個周期的長度均等。但是,由於更大的原子擁有更多的電子支殼層,現代的周期表中較下的周期長度較長。
通過製造超鈾元素,周期表經過極大的擴充,從1939年合成的鎿開始。由於許多的超鈾元素都高度不穩定並很快經歷核衰變,因此這些元素在產生後的探測十分困難。最新命名的元素為鎶(原子序112),於2010年2月19日得名。最新接受的元素髮現為(114)和(116),同時於2011年6月1日接受。2010年,一項位於俄羅斯莫斯科州杜布納的俄美合作項目聲稱已成功合成6個Uus原子,因此Uus是目前最新發現的元素。
元素周期表
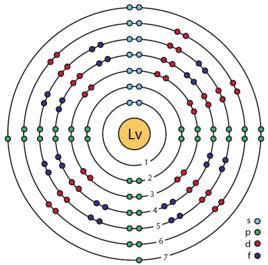
 116 元素
116 元素 116 元素
116 元素| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | IA | VIIIA (0) | |||||||||||||||||||
| 1 | 1 H 氫 1.008 | IIA | IIIA | IVA | VA | VIA | VIIA | 2 He 氦 4.003 | K | 2 | |||||||||||
| 2 | 3 Li 鋰 6.941 | 4 Be 鈹 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 22.99 | 12 Mg 鎂 24.31 | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | 13 Al 鋁 26.98 | 14 Si 矽 28.09 | 15 P 磷 30.97 | 16 S 硫 32.07 | 17 Cl 氯 35.45 | 18 Ar 氬 39.95 | M L K | 8 8 2 | |||
| 4 | 19 K 鉀 39.1 | 20 Ca 鈣 40.08 | 21 Sc 鈧 44.96 | 22 Ti 鈦 47.88 | 23 V 釩 50.94 | 24 Cr 鉻 52.00 | 25 Mn 錳 54.94 | 26 Fe 鐵 55.85 | 27 Co 鈷 58.93 | 28 Ni 鎳 58.69 | 29 Cu 銅 63.55 | 30 Zn 鋅 65.39 | 31 Ga 鎵 69.72 | 32 Ge 鍺 72.59 | 33 As 砷 74.92 | 34 Se 硒 78.96 | 35 Br 溴 79.90 | 36 Kr 氪 83.80 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 85.47 | 38 Sr 鍶 87.62 | 39 Y 釔 88.91 | 40 Zr 鋯 91.22 | 41 Nb 鈮 92.91 | 42 Mo 鉬 95.94 | 43 Tc 鎝 (97.91) | 44 Ru 釕 101.1 | 45 Rh 銠 102.9 | 46 Pd 鈀 106.4 | 47 Ag 銀 107.9 | 48 Cd 鎘 112.4 | 49 In 銦 114.8 | 50 Sn 錫 118.7 | 51 Sb 銻 121.8 | 52 Te 碲 127.6 | 53 I 碘 126.7 | 54 Xe 氙 131.3 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 132.9 | 56 Ba 鋇 137.3 | 57- 71 鑭系 元素 | 72 Hf 鉿 178.5 | 73 Ta 鉭 180.9 | 74 W 鎢 183.9 | 75 Re 錸 186.2 | 76 Os 鋨 190.2 | 77 Ir 銥 192.2 | 78 Pt 鉑 195.1 | 79 Au 金 197.0 | 80 Hg 汞 200.6 | 81 Tl 鉈 204.4 | 82 Pb 鉛 207.2 | 83 Bi 鉍 209.0 | 84 Po 釙 (209.0) | 85 At 砹 (210.0) | 86 Rn 氡 (222.0) | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 (223.0) | 88 Ra 鐳 226.0 | 89- 103 錒系 元素 | 104 Rf 鑪 (265.1) | 105 Db (268.1) | 106 Sg (271.1) | 107 Bh (270.1) | 108 Hs (277.2) | 109 Mt 䥑 (276.2) | 110 Ds (281.2) | 111 Rg 錀 (280.2) | 112 Cn 鎶 (285.2) | 113 Nh 鉨 (284.2) | 114 Fl (289.2) | 115 Mc 鏌 (288.2) | 116 Lv (293.2) | 117 Ts 石田 (294.2) | 118 Og (294.2) | Q P O N M L K | 8 18 32 32 18 8 2 | |
| 鑭系元素 | 57 La 鑭 138.9 | 58 Ce 鈰 140.1 | 59 Pr 鐠 140.9 | 60 Nd 釹 144.2 | 61 Pm 鉕 (144.9) | 62 Sm 釤 150.4 | 63 Eu 銪 152.0 | 64 Gd 釓 157.3 | 65 Tb 鋱 158.9 | 66 Dy 鏑 162.5 | 67 Ho 鈥 164.9 | 68 Er 鉺 167.3 | 69 Tm 銩 168.9 | 70 Yb 鐿 173.0 | 71 Lu 鑥 175.0 | ||||||
| 錒系元素 | 89 Ac 錒 (227.0) | 90 Th 釷 232.0 | 91 Pa 鏷 231.0 | 92 U 鈾 238.0 | 93 Np 鎿 237.1 | 94 Pu 鈽 244.1 | 95 Am 鎇 (243.1) | 96 Cm 鋦 247.1 | 97 Bk 錇 (247.1) | 98 Cf 鐦 (252.1) | 99 Es 鑀 (252.1) | 100 Fm 鐨 (257.1) | 101 Md 鍆 (258.1) | 102 No 鍩 (259.1) | 103 Lr 鐒 (262.1) | ||||||
圖解
鹼金屬
鹼土金屬
鑭系元素
錒系元素
過渡金屬
主族金屬
類金屬
非金屬
鹵素
稀有氣體
待確認化學特性
序號綠色在標準狀況下為氣體;序號藍色為液體;序號黑色為固體;序號灰色為未知相態。
所有版本的元素周期表都只包含化學元素,而不包含混合物、化合物或亞原子粒子。每個元素的各個同位素都在同一格中表示。在標準周期表中,元素依照其原子序(原子核中質子的數量)順序排列。當一個電子開始填充新的原子殼層時,周期表另起一行(周期)。元素的某個電子支殼層擁有的電子數決定元素的列(族),如氧和硒在最外的p支殼層均有4個電子。周期表中較低的周期較長,較右的族較長(但最大的鹼金屬族卻是位於最左,而第二大的鹼土金屬族則在鹼金屬族右邊)。一般來說,化學特性相似的元素在周期表中歸在同一族中,但是在f-區和d-區中,某些同周期的元素有著相似的特性。因此,如果知道鄰近元素的特性,便能相對輕易地預測到某化學元素的特性。在一些元素周期表里(如化學星空)存在0號元素,這是指原子中僅含中子,不含質子的一種假像元素,但這種用法存有爭議。
截至2014年,周期表包含118個經過證實的化學元素,其中114個受國際純粹與套用化學聯合會(IUPAC)承認並命名。當中98個元素存在於自然界中:84個為原生核素,另有14個元素只出現在原生元素的衰變鏈里。從鑀到鎶的所有元素雖然不在宇宙中自然產生,但是由於經過人工合成,現已全被IUPAC承認。從Uut至Uuo的元素曾在實驗室中被合成,現在根據其原子序系統性地得名。所有鑀(原子序99)以後的元素都沒有經過在巨觀尺度下的觀察。到2013年為止,人們還沒有成功合成原子序118之後的任一個元素。
在印刷版或其他正式的周期表中,每個元素格內通常有幾項元素的基本特性:原子序、化學符號和名稱。其他常見的特性包括:原子量、密度、熔點、沸點、固態晶體結構、來源、電子排布、負電性和最常見的化合價。
根據定義,每個化學元素都有它唯一的原子序,相等於其原子核中質子的數量,而大部分元素的各個原子有不同的中子數,這稱作同位素。例如,所有碳原子都有6顆質子,其中大部分有6顆中子,但1%有7顆中子,另外很小一部分(碳-14)更有8顆中子。因此碳有3個自然同位素。周期表中從來不區分同位素,而是把它們歸在同一個元素之下。沒有穩定同位素的元素在表中標以其最穩定的同位素質量,以括弧括住。
排版
在現代的周期表中,元素根據原子序的順序從左至右排列,並在每個惰性氣體後另開一行。新一行的第一個元素一定是鹼金屬,其原子序比前一個惰性氣體大一(例如,惰性氣體氪的原子序為36,而新一行始於鹼金屬銣,原子序為37)。目前表中沒有任何空格,因為從氫到Uuo的所有元素都已被發現。由於元素均以原子序順序編號,因此在提到一系列元素時,往往會使用“鐵至鋅”、“鈾之後”等字詞。“輕”和“重”也會非正式地用於表示元素的相對原子序(而非密度),如“比碳輕”和“比鉛重”等,然而元素的質量並不一定隨著原子序增加。如52號元素碲的平均重量比53號的碘要高。
氫和氦經常被放置在與它們根據電子排布似乎應在的區塊不同的位置。氫通常在鋰之上,但有時也會在氟甚至碳之上。氦則幾乎永遠在氖之上,因為兩者的化學特性十分相似。
直到質子和中子被發現和了解了之前,周期表中元素根據原子序排列這一規則並沒有重要性。門捷列夫的周期表採用的排列方式是根據原子量,因為原子量的測量在當時已有一定的準確性。在絕大多數情況下,這一規則能對元素特性給出比當時所有其他理論都好得多的預測。在明白並沿用了原子序之後,元素的排列有了確切的整數依據,在能夠人工合成新元素的今天仍被廣泛地使用。
周期性趨勢
周期表中的一些趨勢
一個元素的特性的主要決定因素是其電子排布,其中價電子殼層中的排布最為重要。譬如,p殼層有4顆價電子的元素會有類似的特性。原子最外層的電子所在的殼層將決定元素所屬的“區”。價電子的數量則決定元素所屬的“族”。原子中電子殼層的數量決定元素的“周期”。每個殼層分為支殼層,而電子填充支殼層的順序根據下表(構造原理),並且決定了周期表的結構。由於外層電子決定化學特性,因此擁有相同數量的價電子的元素通常位於同一族內。
| 支殼層 | s | f | d | p |
| 周期 | ||||
| 1 | 1s | |||
| 2 | 2s | 2p | ||
| 3 | 3s | 3p | ||
| 4 | 4s | 3d | 4p | |
| 5 | 5s | 4d | 5p | |
| 6 | 6s | 4f | 5d | 6p |
| 7 | 7s | 5f | 6d | 7p |
在同一族中的元素,隨著原子量的增加,外層的電子(最容易參與化學反應)都位於同一種殼層中,殼層的形狀相似,但能量和平均與原子核的距離逐漸增加。例如第一族的外層電子(價電子)從氫開始都是位於s殼層中。氫原子中的s殼層是任何原子中能夠占據的最低能量的殼層,因此氫位於周期表的第一位。鍅是這一族中最重的元素,其外層電子位於第7殼層,比其他更低能量的電子殼層距離原子核更遠。
注意隨著原子序(質子數量)增加,原子核與電子之間會產生更強的自旋-軌道作用,降低了量子力學殼層模型的準確度,因為該模型假設每個殼層分別為一獨立的物體。
族[編輯]
主條目:族 (化學)
“族”指的是周期表中的一列,並且是最重要的元素分類方法。在某些族裡,各個元素之間有著相近的特性,並隨著質量的增加有明顯的趨勢。根據國際命名系統,各族從左至右標1(鹼金屬)至18(惰性氣體)。舊有的命名系統在歐洲和美國有所差別(本節中的周期表用了舊有的美國命名系統)。
某些族還有非系統命名,如鹼金屬、鹼土金屬、鹵素、氮族元素、氧族元素和惰性氣體。但是其他的族,如7族元素,並沒有額外的名稱,因為這些族中元素特性的相似度不高,或趨勢並不明顯。
現代量子力學理論通過假設同一族中的元素在價電子殼層的排布相同,能夠解釋許多的族內趨勢。
同族的元素在原子半徑、電離能及負電性都有相同的模式。從上到下,族內元素的原子半徑增加。由於填滿的能級更多,因此價電子距離原子核更遠。而元素的電離能則有下降的趨勢,因為越遠的電子越容易被移除。同樣,負電性亦會下降,因為價電子和原子核的距離更遠。
周期
元素周期
電離能的周期性趨勢。每個周期從鹼金屬最低點開始,到惰性氣體時達到最高點。
“周期”指的是周期表中的一行。雖然族是最常見的分類方法,但是有些元素的橫向趨勢比豎向趨勢更為明顯,如f區塊中橫向的鑭系元素和錒系元素。
同一周期的元素在原子半徑、電離能、電子親和能及負電性都有趨勢。周期中從左至右的元素原子半徑一般降低,因為額外的一顆質子和一顆電子使電子距離原子核更近。下降的原子半徑也使電離能的增加,因為越緊的原子中所需移除電子的能量就越高。同樣,更接近原子核的電子使元素的負電性增加。一個周期中,電子親和能也有一點趨勢:左邊金屬一般比右邊非金屬的電子親和能高,惰性氣體除外。
區塊
主條目:元素分區
元素分區,使用美國的CAS編號法。
由於外層電子殼層的重要性,因此周期表中不同的區域有時被稱為“區塊”,根據最後一顆電子所在的支殼層命名。首先,s區塊包括首兩族(鹼金屬和鹼土金屬),再加上氫和氦;p區塊包括13至18族,其中包含了所有的類金屬;d區塊包含3至12族,其中包含所有的過渡金屬;f區塊通常整個顯示在周期表的下方,包含所有的鑭系元素和錒系元素。
變化
鑭系元素和錒系元素兩行一般顯示在周期表主體的下方,並在主體中留空兩格,或以兩個元素代替(鑭或鑥,及錒或鐒),分別置於鋇和鉿之間,及鐳和鑪之間。這項慣例的實行完全是因排版格式的緣故,而另一種不甚常見的周期表將鑭系元素和錒系元素置於主體中相應的位置上,作為周期表的第6及第7行。
位於主體內的f區塊
許多周期表沿著類金屬畫一條深色階梯線,金屬位於左邊,而非金屬位於右邊。不同的元素分類有時也會表現在周期表上,如過渡金屬、貧金屬和類金屬。另外也存在非正式的分類,如鉑系元素和抗腐蝕金屬,但在周期表中甚少註明。
其他周期表
現代的左排周期表,ADOMAH周期表
以上的周期表是最常用的一種,但周期表也有其它的形式,除了各種矩形的之外,還包括圓形和圓柱體形的。這些周期表通常用以強調傳統周期表中並不明顯的元素特性。某些周期表注重於核子和電子結構,這能通過改變周期表中元素之間的相對位置來表現。另外的周期表強調人類提煉出純元素的時序。
一種常見的另類形式為沙爾·珍奈的左排周期表,其中的元素根據電子殼層的填充排列。其現代版本ADOMAH周期表有助找出元素的電子排布,並和傳統周期表呈90度角。當中的s區塊位於惰性氣體之後。
另一個常見的形式為Theodor Benfey的周期表,其中的元素以螺旋形排列。氫在中心,其它元素螺旋向外,而過渡金屬、鑭系元素和錒系元素為圖中的“半島”形。
另外還有三維的周期表,如Paul Giguere的周期表。四塊平板互相連線,各代表一個區塊,元素印在平板的正反面。氫和氦不在表內。
未來發展
主條目:擴展元素周期表
儘管直到Uuo的所有元素都已被發現,但是只有直到(108)和鎶有已知的物理和化學特性。其他的元素可能和趨勢所預計的有所不同,因為超重元素的相對論性效應。譬如Fl有可能是一個惰性氣體,雖然它屬於碳族元素。
目前未知新的元素是否會延續周期表的格式,成為第8周期元素,還是需要更改排列方式。格倫·西奧多·西博格預計第8周期有兩個s區塊元素Uue(119)和Ubn(120)、其後18個g區塊元素以及30個額外元素,延續已有的f、d和p區塊。另一方面,如Pekka Pyykkö等的某些物理學家提出,這些新的元素並不符合構造原理,並有著不同的電子排布原理,因此會影響在周期表中的排列方式。
理察·費曼表示粗略地理解相對論性狄拉克方程式得出的結論是,原子序大於137時,電子殼層會發生問題,所以在Uts之後不可能存在中性原子,根據電子排布整理的周期表在此處也因此瓦解。更嚴謹的分析得出極限在原子序等於173時發生。
玻爾模型
玻爾模型在原子序大於137時出現問題,因為在1s電子殼層中電子的速度 v為
其中 Z為原子序, c為光速, α為精細結構常數。在這個模型下, Z大於137的原子中1s電子的速度會超過光速。因此在Z > 137時必須使用相對論性模型。
狄拉克方程式
相對論性狄拉克方程式也在 Z> 137時瓦解,因為其基態能量為
其中 m為電子的靜止質量。當 Z> 137時,狄拉克基態的波函式是波動的,並且在正負能量範圍之間沒有空隙,形成與克萊因佯謬相似的情況。考慮到有限原子核大小的更準確的計算指出,當 Z> Z≈ 173時結合能超過電子靜止時的能量的兩倍。空缺的最內部殼層會導致一顆電子憑空產生,同時發射一顆正子。