化學物質
現已公布的從自然界篩選的和人工突變的具有高特異性的鋅指蛋白可以識別所有的GNN和ANN以及部分CNN和TNN三聯體。多個鋅指蛋白可以串聯起來形成一個鋅指蛋白組識別一段特異的鹼基序列,具有很強的特異性和可塑性,很適合用於設計ZFNs。與鋅指蛋白組相連的非特異性核酸內切酶來自FokI的C端的96個胺基酸殘基組成的DNA剪下域(Kim et al., 1996)。FokI是來自海床黃桿菌的一種限制性內切酶,只在二聚體狀態時才有酶切活性(Kim et al., 1994),每個FokI單體與一個鋅指蛋白組相連構成一個ZFN,識別特定的位點,當兩個識別位點相距恰當的距離時(6~8 bp),兩個單體ZFN相互作用產生酶切功能。從而達到 DNA 定點剪下的目的。
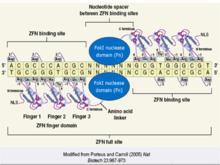 鋅指核糖核酸酶結構示意圖
鋅指核糖核酸酶結構示意圖該技術一直以來被Sangamo生物公司所壟斷,該公司只與部分科研機構合作。現在這種形勢得到了改變,一個由八個實驗室組成的協會,在分子生物學家J. Keith Joung的帶領下,提出了製造ZFN的一種開源方式(Maeder et al., 2008)。該組織建立了66個“鋅指”庫,選擇性地針對不同的DNA序列。從庫中建立的“鋅指核酸酶”在測試一個植物基因和三個人類基因時大概有1-50%的高效率,這種效率可以與Sangamo、經典基因立法相媲美。
一種DNA靶向技術,若套用於實際的科研或醫療中,需要有高度的特異性,即要避免脫靶效應(off-target) 。然而事實上,DNA剪下的準確性由於ZFN剪下的機制而並不像人們預期的那樣強:DNA的剪下需要兩個FokI切割區域的二聚化,和至少一個單元結合DNA。因為二聚化的過程是獨立於DNA剪下的,異二聚體的形成,和兩種單元所形成的同源二聚體,同樣可以造成DNA的剪下,並且他們有著不同的識別序列。可以想像,具有較低特異性的同源二聚體形式的ZFN會切割基因組中的假迴文序列。而且,在某些特定條件下,單一ZFN單元結合於DNA(識別序列只有9~12 bp)也會造成DNA的剪下。如此,兩個不同的ZFN單元總共可能產生七種不同識別序列的內切酶。這些非特異性行為均可能帶來ZFN毒性。
Miller等人和Szczeoek等人(2007)分別改進了這一技術。他們構建了一系列偏愛異二聚體形成的FokI酶。通過審查FokI的晶體結構,兩個小組均對介導酶的兩個單元結合的兩個alpha螺鏇上的胺基酸做了突變,以減少同源二聚體的形成:研究人員構建了一對不對稱的界面。雖然脫靶顯現明顯減少,但是仍然不可避免單個ZFN單元結合於DNA時發生的酶切,也許進一步的發展中,人們需要徹底破壞FokI部分結合DNA的能力。
ZFNs 曾用於增強非洲爪蟾卵細胞、線蟲、果蠅及斑馬魚細胞的同源重組(Bibikova et al., 2001; Morton et al., 2006; Meng et al, 2008; Doyon et al., 2008)。在果蠅中ZFNs介導的同源重組頻率相當可觀,有時大於1%的子代發生了同源重組介導的基因打靶事件(Beumer et al., 2006)。在斑馬魚中,30%-50%的個體將ZFN誘導的突變傳給了子代,而7%~18%的子代為突變型。通過SOLEXA測序發現,在形態正常的胚胎中,脫靶現象僅出現1%。在植物上,Lloyd 等(2005)在擬南芥中用ZFN誘導了染色體基因的定點突變,後代的突變率高達 20%。Voytas的研究小組證明ZFNs可以提高植物基因定點整合和置換頻率。他們在實驗中設計了一個缺失了600bp的靶基因GUS:NPTII,將含有該600 bp的同源DNA片段和ZFNs瞬時表達載體共同轉化菸草原生質體,轉化細胞的10%獲得基因定點置換,比不用ZFNs時效率提高了104~105倍。分子檢測表明20%的重組事件是精確的,沒有伴隨鹼基的缺失或插入(Wright et al.,2005)。這一結果表明利用ZFNs定點切割染色體DNA,可以顯著提高同源重組介導的基因定點整合效率,這為基因定點整合和置換提供了一個非常有潛力的工具。
套用前景
ZFN技術亦具有潛在的臨床套用前景。傳統的基因治療的方式主要有兩種,一種是利用病毒攜帶完整的基因序列送入人體內或者是注入一小段正確的DNA序列來修正錯誤或者使錯誤的基因不表現,然而到目前為止,事實上科學家都無法確認這些方法在實際套用上是有效率及安全的。而藉由同源互換的原理使得細胞自行修正錯誤的DNA序列是發展基因治療上最基本的原則。這一過程通過兩個獨立的步驟完成:首先在DNA中引入一個雙鏈斷裂,啟動細胞自身的修復系統;之後“同源重組”參考引入的相似序列作為模板修復這段基因,從而實現指定部位的鹼基替換。
Urnov et al. (2005)針對一個IL2R基因上的突變而引起嚴重的免疫不全症 [X-linked severe combined immune deficiency (SCID)] 來設計了四指的ZFN. SCID會使T細胞失去對抗外界入侵及感染的能力,而科學家們結合注入正確的DNA片段及ZFN的方式在培養皿中處理這些SCID的T細胞。利用該系統介導了人類細胞IL2R酌的高效修復。在無選擇壓力下修復效率達15%~18%,而實際在體內,修正後的細胞比原來的突變細胞具有選擇優勢,故這樣的修復效率已足夠用於基因治療。這樣的操作與傳統的逆轉錄病毒等技術相比,具有明顯的優勢:他沒有造成人們所不希望的基因重組的風險,因為它修正錯誤的序列,而非增加一個正確的拷貝。這給利用ZFN進行基因修復帶來希望。
但是ZFN技術用於臨床治療還有很長的路要走。例如,人們不能預期引入的ZFN蛋白是不是會引起免疫系統的進攻。並且至少到目前為止,這樣的技術似乎只能用於那些可以從病人體內抽取出來的細胞,對他們進行體外操作,再注回病人體內:直接體內注入基因的效率還太低了。最後,ZFN操作在細胞內到底精確程度如何,也必須小心評估:極少的錯誤也可能導致產生細胞癌變等嚴重的後果。
