規則溶液
正文
混合熱不為零,混合熵與理想溶液混和熵相同的溶液,又稱為正規溶液。它是1927~1929年由希耳德布蘭特(J.H.Hildebrand)提出用來對真實溶液作近似描述的一種簡單模型,所以又稱Hildebrand模型。熱力學推導指出,規則溶液具有下列性質:①溶液中組分i的偏摩爾焓啛i與純i組分的摩爾焓H孂之差(即偏摩爾混合熱Δ啛i)等於RT lnγi,即:

②對A-B二元規則溶液,其活度係數γΑ、γA與摩爾分數NΑ、NA的關係為:
lnγΑ=aN娢=a(1-NΑ)2
lnγA=aN娞=a(1-NA)21摩爾溶液的混合熱為:
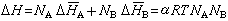
利用規則溶液模型來處理金屬溶液、熔鹽、熔渣,可以簡化其熱力學性質與組成的關係。

