簡介
絕熱壓縮係數又稱“定熵壓縮係數”。表示簡單可壓縮系統在定熵過程中比容隨壓力的變化率與比容的比值。是表示物質系統在可逆絕熱條件下相對壓縮性的常用熱係數之一。常以符號“β”表示,單位為 “m/N”或“Pa”。數學表達式為:
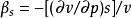 絕熱壓縮係數
絕熱壓縮係數式中,v、p、s分別為該簡單可壓縮系統的比容 (m/kg)、絕對壓力 (Pa)和比熵[kJ/(kg·K)]。在可逆絕熱條件下物質系統的比容總是隨其壓力的提高而減小,即偏導數(∂v /∂p)恆為負值,故β恆為正值。 絕熱壓縮係數對研究簡單可壓縮系統的熱力學性質具有重要的意義。
絕熱壓縮
氣體在和外界沒有熱交換的情況下進行的壓縮過程叫絕熱壓縮。在熱力學中,可逆絕熱壓縮是等熵過程。這時對體系進行壓縮所作的功等於體系內能的增加。絕熱壓縮一般指流體在穩流狀態下,在其位能和動能可忽略的情況下,經歷絕熱節流,通過壓縮導致增大壓力,此壓縮為絕熱壓縮。根據熱力學第一定律,經常用於升高流體的溫度,起到加熱的效應。
絕熱壓縮發生在氣壓上升時,這時氣體溫度也會上升。例如,給腳踏車打氣時,可以感覺到氣筒溫度上升,這正是因為氣體壓強上升的足夠快到可視為絕熱過程的緣故,熱量沒有逃逸,因而溫度上升。柴油機在壓縮衝程時正是靠絕熱壓縮原理來給燃燒室內的混合氣體點火的。
絕熱過程
絕熱壓縮屬於絕熱過程,絕熱過程熱力學系統始終不與外界交換熱量, 即dQ =0 的過程。根據熱力學第一定律,在絕熱過程中,系統對外所作的功等於內能的減少量。根據熱力學第二定律,在可逆的絕熱過程中,系統的熵不變。用良好絕熱材料隔絕的系統中進行的過程,或由於過程進行得太快,來不及與外界有顯著熱量交換的過程,都可近似地看作絕熱過程。例如內燃機、蒸汽機汽缸中工作物質的膨脹過程, 壓汽機汽缸中的壓縮過程,汽輪機噴管中的膨脹過程,以及氣象學中空氣團的升降過程,還有聲波在空氣中的傳播過程等,都可當作絕熱過程處理。
絕熱過程是一個絕熱體系的變化過程,絕熱體系為和外界沒有熱量和粒子交換,但有其他形式的能量交換的體系,屬於封閉體系的一種。絕熱過程有絕熱壓縮和絕熱膨脹兩種。
絕熱過程分為可逆過程(熵增為零)和不可逆過程(熵增不為零)兩種。可逆的絕熱過程是等熵過程。等熵過程的對立面是等溫過程,在等溫過程中,最大限度的熱量被轉移到了外界,使得系統溫度恆定如常。由於在熱力學中,溫度與熵是一組共軛變數,等溫過程和等熵過程也可以視為“共軛”的一對過程。
等熵過程
等熵過程又叫可逆絕熱過程。所謂絕熱過程乃是氣體在和外界沒有熱量交換的條件下進行的熱力過程。當過程進行的很快時,工質與外界還來不及與外界交換熱量或是交換熱量很少,則可近似地看作絕熱過程。渦輪噴氣發動機的壓氣機內空氣的壓縮過程,燃氣在渦輪內和尾噴管內進行的膨脹過程,都可近似地看作絕熱過程。
在等熵過程中,不僅氣體與外界交換的總熱量為零,而且在過程進行的每一微元段與外界交換熱量也是零,所以可逆絕熱過程是dp=0和q=0。
等熵過程分為可逆乾絕熱過程和可逆濕絕熱過程。
一、可逆乾絕熱過程
對於定質量的氣塊,它的狀態是由氣壓(p)、溫度(T)、和任意一個濕度參數(如比濕q)共同決定,而氣塊在垂直升降運動過程中其狀態不斷發生變化,因此必須獲得氣塊狀態變數隨高度變化規律。
在垂直升降運動過程中,氣塊中所含的水汽始終未達到飽和,沒有發生相變的絕熱過程,稱為乾絕熱過程。這裡的乾表示未飽和氣塊在絕熱過程中沒有發生水相的變化,並非指不含有水汽。由於滿足垂直運動的三個基本假設,即絕熱條件、準靜態條件、靜力平衡條件,因此他又是可逆過程,常稱為可逆乾絕熱過程。
二、可逆濕絕熱過程
氣塊上升時到等熵凝結高度以上,水汽開始凝結並釋放出潛熱,如果飽和氣塊繼續上升且凝結物全部保留在氣塊內,並與外界無熱量交換;當氣塊下沉增溫濕,這些凝結物又蒸發,使氣塊始終維持飽和狀態,所耗的潛熱與原來釋放的潛熱相等,沿逆過程後仍能回到原來的狀態,這樣的過程稱為可逆濕絕熱過程,又稱為濕絕熱過程,這裡的“濕”表示在飽和的絕熱氣塊內發生水相變化。
可逆濕絕熱過程是一個等熵過程,雖然在可逆式絕熱過程中發生了相變,但水汽和凝結出來的液態水總質量(mv+mt)不變,乾空氣品質md也不變。因此可以利用熵函式來推導濕絕熱方程。由於可逆過程熵不變,即dS=0,即可得到可逆濕絕熱方程。
