成份
 米開民
米開民本品主要成份為米卡芬淨鈉。
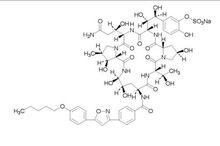
化學名稱:5-[(1S, 2S)-2-[(3S,6S,9S,11R,15S,18S,20R,21R,24S,25S,26S)-3-[(R)-2-氨甲醯基-1-羥乙基]-11,20,21,25-羥丁基-15-[(R)-1-羥乙基]-26-甲基-2,5,8,14,17,23-六氧代-18-[4-[5-(4-戊氧基苯基)異惡唑-3-基]苯甲醯氨基]-1,4,7,13,16,22-六氮雜三環[22.3.0.0[sup]9,13[/sup]]二十七-6-基]-1,2-二羥乙基]-2-羥苯基硫酸鈉
化學結構式:
分子式:CHNNaOS
分子量:1292.26
輔料:乳糖、無水枸櫞酸、氫氧化鈉。
性狀
 米開民
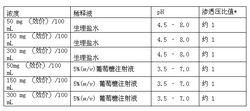
米開民本品為白色塊狀物。
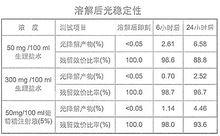
本品溶於生理鹽水或5%葡萄糖注射液後的pH 值及與生理鹽水的滲透壓比值如下表所示:
*與生理鹽水的比值
適應症
由麴黴菌和念珠菌引起的下列感染:真菌血症、呼吸道真菌病、胃腸道真菌病。
規格
50mg (按CHNNaOS 計)
用法用量
麴黴病:
成人一般每日單次劑量為50-150 mg 米卡芬淨鈉, 每日一次靜脈輸注。對於嚴重或者難治性麴黴病患者,根據病人情況劑量可增加至300 mg/天。
念珠菌病:
成人一般每日單次劑量為50 mg 米卡芬淨鈉,每日一次靜脈輸注。對於嚴重或者難治性念珠菌病患者,根據病人情況劑量可增加至300 mg/天。
靜脈輸注本品時,應將其溶於生理鹽水、葡萄糖注射液或者補充液,劑量為75 mg 或以下時輸注時間不少於30 分鐘,劑量為75 mg 以上時輸注時間不少於1 小時。切勿使用注射用水溶解本品(該溶液為非等滲性)。
注意:由於將本品劑量增加至每天300mg 用以治療嚴重或難治性感染的安全性尚未完全確立,故在此用量時必須謹慎,如密切觀察患者的病情。[在日本還沒有每日用量超過150mg 的臨床經驗,在其他國家每天用300mg 的臨床經驗也非常有限]。體重為50 kg 或以下的患者,劑量不應超過每天每公斤體重6 mg 。
不良反應
 米開民
米開民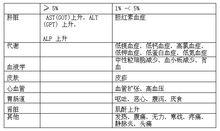 米開民
米開民在日本II 期臨床試驗中,67 例接受治療的患者中有12 例(17.9% )報告了12 件對本品的不良反應(不包括異常實驗室檢查值),其中靜脈炎2 例(3.0%),關節炎、血管疼痛、寒戰、頭痛、高血壓、心悸、腹瀉、稀便、皮疹和斑丘疹各1 例(1.5%)。實驗室檢查值異常有:67 例中發生3 件ALP 上升(4.5%),67 例中發生3 件BUN 上升(4.5%),66 例中發生2 件γ-GT 上升(3.0%),67 例中發生2 件ALT(GPT)上升(3.0%),67 例中發生2 件肌酐上升(3.0%)等。
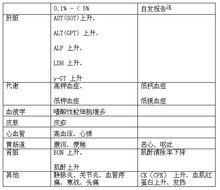
(1)臨床可能出現的不良反應
血液學異常:可能發生中性粒細胞減少症(發生率1.5%)、血小板減少或溶血性貧血(自發報告[sup]注[/sup])。應通過定期檢查等密切監測患者,如果觀察到類似異常必須採取適當措施如停止治療。
休克、過敏樣反應:可能發生休克或過敏樣反應(自發報告[sup]注[/sup])。必須密切觀察患者,一旦發現異常如血壓下降、口腔不適、呼吸困難、瀰漫性潮紅、血管神經性水腫或蕁麻疹等,應停止治療。必要時必須採取適當措施如保持呼吸道通暢、或者使用腎上腺素、類固醇激素或抗組胺藥等。
肝功能異常或黃疸:可能出現AST(GOT)上升、ALT(GPT)上升、γ-GT 上升等肝功能異常或黃疸(自發報告[sup]注[/sup])。應通過定期檢查等嚴密監測患者,如果觀察到此類異常必須採取適當措施如停止治療。
急性腎衰:嚴重腎功能不全如急性腎衰可能會發生(自發報告[sup]注[/sup])。應通過定期檢查等對病人密切監測,如果觀察到此類異常必須採取適當措施如停止治療。
(注):由於是自發報告,未計算發生率。
(2) 其他不良反應
(注)由於下述原因未計算發生率:進行實驗室檢查的病例數非常有限、自發報告或該不良發應只在日本以外發生。
在日本以外地區[sup]注[/sup],556 例進行安全性評價的真菌感染患者中有217 例(39.0% )報告了對本品的不良反應(包括實驗室檢查值異常)。主要不良反應為: AST(GOT)上升37 件(6.7%), ALT(GPT)上升32 件(5.8%), ALP 上升31 件(5.6%),嘔吐27 件(4.9%), 白細胞減少24 件(4.3%),低鎂血症24 件(4.3% )等。
(注): 臨床研究包括最低有效劑量探索研究、侵襲性麴黴菌病研究和念珠菌血症或侵襲性念珠菌病研究。這些研究中發生率在1%或以上的不良反應如下表所示。
禁忌
禁用於對本產品任何成分有過敏史者。
注意事項
 米開民
米開民下列患者應慎用米卡芬淨:有藥物過敏史的患者;肝功能不全患者(使用本品可能使肝功能不全加重)。患者使用本品可能會出現肝功能異常或黃疸。(見“不良反應”部分)。另外,在動物試驗中觀察到高劑量治療組有肝臟損害(見藥理毒理部分),應通過肝功能檢查等試驗嚴密監測患者的肝功能。
如果確定病原體不是麴黴菌或念珠菌,或者使用本品後無效,必須採取適當措施如換用其他藥物。
在一項體外研究中,米卡芬淨與伊曲康唑合用降低了後者抗新型隱球菌[sup]注[/sup]活性。
(註:本品對隱球菌屬無適應症)
配製時注意:溶解本品時切勿用力搖晃輸液袋,因本品容易起泡且泡沫不易消失。
給藥時注意:因本品在光線下可慢慢分解,應避免陽光直射。如果從配製到輸液結束需時超過六小時,應將輸液袋遮光。(不必將輸液管遮光。)
貯存條件:不避光,室溫,光照度低於3000lux
配伍禁忌:當本品與其他藥物一起溶解時可能產生沉澱。而且,本品在鹼性溶液中不穩定,效價會降低。
下列藥物與本藥混合後會立即產生沉澱:鹽酸萬古黴素、硫酸阿貝卡星、硫酸慶大黴素、妥布黴素、硫酸地貝卡星、鹽酸米諾環素、環丙沙星、甲磺酸帕珠沙星、西咪替丁、鹽酸多巴酚丁胺、鹽酸多沙普侖、噴他佐辛、甲磺酸萘莫司他、甲磺酸加貝酯、硫胺素(維生素B)、鹽酸吡哆醇(維生素B)、醋酸羥鈷胺、四烯甲萘醌(維生素K)、凍乾胃蛋白酶處理的正常人免疫球蛋白、鹽酸阿黴素。
下列藥物與本品混合後會立即降低本品的效價:氨苄青黴素、磺胺甲基異噁唑、甲氧苄氨嘧啶、阿昔洛韋、更昔洛韋、乙醯唑胺。
孕婦及哺乳期婦女用藥
孕婦等:孕婦或可能妊娠的婦女,僅在預期治療的益處超過可能產生的風險時方可用藥。(妊娠期婦女用藥的安全性尚未建立。)
哺乳期婦女:建議哺乳期婦女避免使用本品。如果確實有必要使用,治療期間必須停止哺乳。(動物(大鼠)實驗表明本品可分泌至乳汁。[參見“藥代動力學”部分])
兒童用藥
兒童使用本品的安全性尚未確立。
老年用藥
通常老年患者的生理功能下降,故應慎重決定使用劑量,同時要考慮採取其他適當措施。
藥物相互作用
尚不明確。
藥物過量
本品與蛋白高度結合,因此無法通過透析膜。尚未見有米卡芬淨給藥過量的報導,在臨床試驗中兒科病人重複日給藥劑量達4 mg/kg 體重、成年患者達8 mg/kg ,未報告有劑量相關的毒性。成年病人的最大重複日給藥劑量達到了896 mg (8 mg/kg) 。米卡芬淨鈉對大鼠的最低致死量為125 mg/kg ,按體表面積計算約為推薦人用臨床劑量(50 mg 或100 mg/天)的24 倍或12 倍。
藥理毒理
藥理作用
米卡芬淨是一種半合成脂肽類化合物,能競爭性抑制真菌細胞壁的必需成分1,3-β-D 葡聚糖的合成。米卡芬淨對深部真菌感染的主要致病真菌麴黴菌屬和念珠菌屬有廣譜抗真菌活性。在體外試驗中,對耐氟康唑或伊曲康唑的念珠菌屬有強效。米卡芬淨對念珠菌屬有殺真菌作用,而對麴黴菌屬可抑制孢子發芽和菌絲生長。米卡芬淨對小鼠播散性念珠菌病、口腔和食道念珠菌病、播散性麴黴菌病和肺部麴黴菌病具有有效的保護和治療作用。
毒理研究
在對大鼠進行的一項4 周重複靜脈給藥試驗中,高劑量治療組(32 mg/kg )出現血漿AST、ALT 升高,肝臟損害如單細胞壞死。在大鼠13 周和26 周重複給藥試驗中,32 mg/kg 組除出現以上改變外,還出現肝細胞變異灶。不過變異灶在13 周停藥期間沒有進一步發展。在大鼠重複靜脈給藥26 周的研究中,高劑量治療組(32 mg/kg )出現尿量增加、尿中鈉離子和氯離子升高。但是在中劑量治療組(10 mg/kg) 沒有發現任何以上反應。大鼠4 周重複靜脈給藥10 mg/kg 和32 mg/kg 劑量的AUC 分別比人用量300 mg/天時估計AUC 值高0.5 和2 倍。
在犬39 周重複靜脈給藥試驗中(3.2、10、32 mg/kg),中、高劑量治療組出現輸精管萎縮或精子計數減少。
對米卡芬淨鈉未進行過動物長期致癌作用的研究。標準的體內體外組試驗(即細菌回復突變試驗、中國倉鼠肺纖維原細胞染色體畸變試驗、小鼠微核試驗)表明米卡芬淨鈉無致突變性或致染色體斷裂性。
在大鼠生殖和早期胚胎髮育至植入的研究中(3.2 、10和32 mg/kg),所有治療組雄性和雌性母體大鼠生育力和早期胚胎髮育均正常。但中、高劑量治療組出現附睪頭上皮細胞空泡形成,高劑量治療組還出現附睪精子計數減少。
藥代動力學
 米開民
米開民 米開民
米開民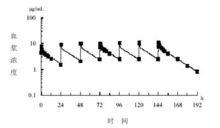 米開民
米開民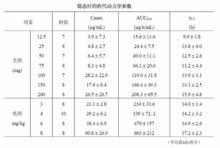 米開民
米開民血漿濃度
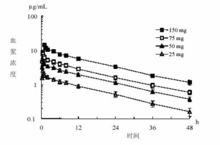
單劑量給藥:23 例健康成人志願者經30 多分鐘靜脈輸注25mg 、50mg 、75mg 米卡芬淨鈉,或經1 小時靜脈輸注150mg 米卡芬淨鈉後,原形藥物的AUC 隨劑量增加而成比例增高。輸注結束時血漿濃度達最大值,消除半衰期為13.9 小時。
(注)本品經批准使用的日劑量為對麴黴菌病50-150 mg(重度或難治性時增至300 mg), 對念珠菌病50 mg (重度或難治性時增至300 mg)。
重複劑量給藥:6 例健康成人志願者經30 分鐘靜脈輸注米卡芬淨鈉75mg ,每日一次, 共7 天,在第4 天時血漿原形藥物濃度達穩態。最後一次給藥時的Cmax 和消除半衰期分別為10.87 µg/mL 和14.0 小時。血漿蛋白結合率為99.8% 或以上。
健康老年人:10例老年志願者(平均年齡71歲,66-78歲)和10例非老年志願者(平均年齡22歲,20-24 歲)經1小時靜脈輸注米卡芬淨鈉50mg ,結果老年組和非老年組血漿原形藥物濃度表現出相似的時程曲線,兩組間Cmax 、AUC0-∞、t1/2 和血漿蛋白結合率沒有差別。
深部真菌感染患者:對65例深部真菌感染患者重複給予12.5mg 、25mg 、50mg 、75mg 、100mg 和150mg 米卡芬淨鈉,其消除半衰期為13.5 小時,各劑量間沒有差異。
接受骨髓或外周造血幹細胞移植的成年患者:經一小時靜脈輸注米卡芬淨鈉12.5-200mg(美國)和3-8mg/kg(約230-600mg,英國),每日一次重複給藥,穩態時(首次給藥後第7天)原形藥物的AUC與給藥劑量成正比,而各劑量的消除半衰期幾乎相同。
(注)本品經批准使用的日劑量為對麴黴菌病50-150 mg(重度或難治性時增至300 mg), 對念珠菌病50 mg (重度或難治性時增至300 mg)。
代謝
已經確定或推測有八個代謝產物。米卡芬淨被認為主要經肝臟代謝。經靜脈輸注後,有3.7%的劑量以主要代謝產物(M5, 米卡芬淨側鏈羥化產物)經尿液和糞便排泄。據推測M5 是由細胞色素P450的CYP1A2 、2B6 、2C和3A催化產生的,兒茶酚產物(M1)是米卡芬淨經硫酸酯酶催化產生的,甲氧基產物(M2)是由M1經COMT(兒茶酚氧位甲基轉移酶)催化產生的,而開環產物(M3)是由米卡芬淨在水溶液中未經酶催化產生的。
排泄
米卡芬淨主要經糞便排泄。6 例國外健康成年志願者經1 小時靜脈輸注28.3mg[sup]14[/sup]C 標記的米卡芬淨鈉,給藥後7 天尿液和糞便中放射性活性的排泄率分別為劑量的7.36% 和43.8%, 尿液和糞便中原形藥物的排泄率分別為劑量的0.70% 和11.71% ,其它均為代謝產物。輸注結束時血漿放射性活性的濃度為2.29 µg eq./mL,給藥後24 小時為0.84 µg eq./mL ,給藥後7 天為0.19 µg eq./mL 。42-51 天后濃度降至0.023 µg eq./mL ,大約為7 天后濃度的1/8 。
哺乳期大鼠經靜脈給予1 mg/kg[sup]14[/sup]C 標記的米卡芬淨鈉,給藥後6 小時乳汁中的放射性濃度達到峰值,幾乎與血漿中的濃度相同。給藥後24 小時乳汁中的放射性濃度與血漿濃度平行下降,半衰期為1.4 天。
貯藏
室溫(10-30℃)下於密閉遮光容器內避光保存。
包裝
10ml玻璃瓶包裝,10 瓶/盒
有效期
暫定36 個月
執行標準
JX20050158
批准文號
國藥準字J20060044
生產企業
Astellas Toyama Co., Ltd. Takaoka Plant
包裝企業
安斯泰來製藥(中國)有限公司
核准日期
2007年01月29日

