成份
 瑞格列奈片
瑞格列奈片本品主要成份為瑞格列奈。
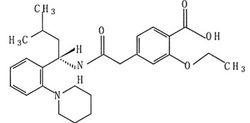
化學名稱:(S)-2-乙氧基-4-[2-[[甲基-1-[2-(1-哌啶基)苯基]丁基]氨基]-2-氧代乙基]苯甲酸。
化學結構式:
分子式:CHNO
分子量:452.59
性狀
本品為白色或類白色片。
規格
(1)1.0mg (2)2.0mg。
用法用量
瑞格列奈片應在主餐前服用(即餐前服用)。在口服瑞格列奈片30分鐘內即出現促胰島素分泌反應。通常在餐前15分鐘內服用本藥。服藥時間也可掌握在餐前0~30分鐘內。
請遵醫囑服用瑞格列奈片。劑量因人而異,以個人血糖而定。推薦起始劑量為0.5mg(1片),以後如需要可每周或每兩周作調整。接受其他口服降血糖藥治療的病人可直接轉用瑞格列奈片治療。其推薦起始劑量為1mg(2片)。
最大的推薦單次劑量為4mg(8片),進餐時服用。但最大日劑量不應超過16mg(32片)。
對於衰弱和營養不良的患者,應謹慎調整劑量。如果與二甲雙胍合用,應減少瑞格列奈片的劑量。儘管瑞格列奈主要由膽汁排泄,但腎功能不全的患者仍應慎用。
不良反應
 瑞格列奈片
瑞格列奈片 瑞格列奈片
瑞格列奈片低血糖:見注意事項和藥物過量。
在臨床試驗中,對2931名受試者試用了瑞格列奈。大約1500名2型糖尿病患者至少接受了3個月的瑞格列奈治療,1000人至少6個月,另有800人至少1年。受試者(1228名)中的大多數人接受了5個為期1年的、陽性對照的試驗中的一個。這些為期1年的陽性對照藥為口服磺醯脲類,包括格列本脲和格列吡嗪,1年之後,瑞格列奈組有13%的患者由於副反應停止了用藥,而磺醯脲組則為14%。最常見的導致停藥的不良反應為低血糖,高血糖和相關的症狀。瑞格列奈組中有16%的患者出現了輕度或者中度的低血糖,格列本脲組則為20%,而格列吡嗪組為19%。
下表(表1)所列是在為期1年的試驗中與空白對照組(12-24周)以及格列本脲組、格列吡嗪組相比較瑞格列奈組常見的不良反應,瑞格列奈組的不良反應大致與磺醯脲組相當。
心血管不良反應
在為期一年的瑞格列奈和磺醯脲類藥物的對照試驗中,兩者心絞痛的發生率相當(1.8%),胸痛的發生率,瑞格列奈組為1.8%,磺醯脲組為1.0%。選擇性心血管不良反應(高血壓、心電圖異常、心肌梗死、心律不齊和心悸)的發生率,瑞格列奈組和對照藥物組沒有差異,均≤1.0%。
在對照比較的臨床試驗中,包括缺血在內的嚴重心血管不良反應的總發生率方面,瑞格列奈組(4%)要高於磺醯脲組(3%)。在一項為期1年的對照試驗中,與其他口服降糖藥觀察到的幾率相比,瑞格列奈治療沒有較高的死亡率。
7項對照臨床試驗中,包括瑞格列奈和低精蛋白鋅胰島素合用(n=431),單用胰島素製劑(n=388)以及其他合用方案(磺醯脲+低精蛋白鋅胰島素,或者瑞格列奈+二甲雙胍)(n=120)。
在兩項研究中,瑞格列奈+低精蛋白鋅胰島素治療的患者中共有6例出現了心肌缺血這一嚴重的不良反應,在另一項研究中,單用胰島索製劑的患者中則有1例出現該不良反應。
其他不良反應
臨床試驗中觀察到的少見臨床和實驗室不良反應包括過敏反應、肝酶升高、血小板減少和白細胞減少;非常罕見的不良反應有眼睛異常(已知血糖水平的改變可導致暫時性的視覺異常,尤其是在開始使用降糖藥物進行治療時,這些改變通常是一過性的)或免疫反應如脈管炎。
雖然尚未確定與瑞格列奈之間的困果關係,但是上市後報導的罕見不良反應如下:脫髮、溶血性貧血、胰腺炎、史—約綜合徵以及嚴重的肝功能異常(如黃疸和肝炎)。
和噻唑烷二酮類合用治療
在一項為期24周的瑞格列奈—羅格列酮或者瑞格列奈—吡格列酮合用治療(共有250名患者參與了合併用藥試驗)的臨床試驗中,合用組的低血糖的(血糖<50mg/dL)發生率為7%。瑞格列奈單用組為7%,噻唑烷二酮組為2%。
250名瑞格列奈—噻唑烷二酮合併用藥的病人中有12名出現了外周型水腫,124名單用噻唑烷二酮治療的患者中有3例報導,而瑞格列奈單用組中沒有報導該不良反應。當對各治療組的脫失率進行校正後,瑞格列奈—噻唑烷二酮合用組的患者每24周發生外周型水腫的幾率為5%,單用噻唑烷二酮組的發生率為4%。有報導,250名瑞格列奈—噻唑烷二酮合用組患者中有2名(0.8%)出現伴隨充血性心肌衰竭的外周型水腫。這兩名患者均有冠心病史,並在服用利尿劑後恢復。單用治療組中並沒有相關可比較的案例報導。
瑞格列奈—噻唑烷二酮合用組的平均體重變化為+4.9kg。瑞格列奈—噻唑烷二酮組沒有患者出現轉氨酶升高(定義為正常值上限的3倍)。
禁忌
以下情況禁用:
1.已知對瑞格列奈或本品中的任何賦型劑過敏的患者。
2.1型糖尿病患者(胰島素依賴型,IDDM),C-肽陰性糖尿病患者。
3.伴隨或不伴昏迷的糖尿病酮症酸中毒患者。
注意事項
1.同其它大多數口服促胰島素分泌降血糖藥物一樣,瑞格列奈片也可致低血糖。
2.與二甲雙胍合用會增加發生低血糖的危險性。如果合併用藥後仍發生持續高血糖,則不宜繼續用口服降糖藥控制血糖,而需改用胰島素治療。
3.在發生應激反應時,如發熱、外傷、感染或手術,可能會出現血糖控制失敗。這時,有必要停止服用瑞格列奈而進行短期的胰島素治療。
4.瑞格列奈片尚未在18歲以下或75歲以上的患者中進行過研究。
5.應儘量避免將瑞格列奈與吉非貝齊合用。如果必須合用,應嚴密監測患者的血糖水平。因為可能需要減少瑞格列奈的用藥劑量。
6.與其它口服降糖藥一樣,患者必須慎用以避免開車時發生低血糖。
7.腎功能不全:雖然瑞格列奈水平與肌酐清除率僅有微弱的聯繫,但本品的總血漿清除率在嚴重腎功能損傷的患者中略有降低。由於腎功能損傷的糖尿病患者對胰島素敏感性增強,這些患者增加劑量時應謹慎(參見【藥代動力學】)。
8.肝功能不全:在通常劑量下,與肝功能正常的患者相比,肝功能損傷患者可能暴露於較高濃度的瑞格列奈及其代謝產物。因此肝功能損傷患者應慎用本品。應延長劑量調整間期,對患者的反應進行充分評估(參見【藥代動力學】)。
孕婦及哺乳期婦女用藥
在孕婦中的使用安全性尚未確認。據國外文獻報導,在懷孕大鼠和孕兔的整個懷孕期間分別給予40倍(大鼠)和0.8倍(兔子)的臨床接觸劑量(單位mg/m2)瑞格列奈的試驗,未見瑞格列奈有致畸作用。因為動物生殖研究與人類之間並不總是存在著相關性,所以,除非有必要否則不能對孕婦使用瑞格列奈。
另外,新近的研究表明懷孕期間的血糖濃度異常會增加先天性畸形的發生率,因此許多專家建議在懷孕期間應使用胰島素將血糖維持在接近正常的水平。
據國外文獻報導,在大鼠生殖試驗中,從大鼠乳汁中能夠檢測到瑞格列奈,並且觀察到了幼崽血糖降低的現象。雖然瑞格列奈在人體會不會經由乳汁分泌尚不得知,但是目前已知某些藥物就是通過這種途徑被排泄的。由於可能會導致哺乳嬰兒發生潛在的低血糖,且在哺乳期動物幼崽中已經觀察到這種效應,所以哺乳期婦女要么停止用藥,要么停止授乳。如果選擇停用瑞格列奈以繼續授乳,但是單純飲食控制治療卻不是以有效控制血糖,應考慮使用胰島素來控制血糖。
兒童用藥
瑞格列奈片尚未在18歲以下患者中進行過研究。
老年用藥
瑞格列奈片尚未在75歲以上的患者中進行過研究。
藥物相互作用
已知一些藥物會影響糖代謝。因此醫生應考慮可能的藥物相互作用。
體外研究表明瑞格列奈由細胞色素酶P450中的2C8酶和3A4酶代謝。
在健康受試者中開展的臨床研究數據表明,CYP2C8在瑞格列奈的代謝過程中起主要作用,而CYP3A4強抑制劑的作用有限。但如果CYP2C8的作用受到抑制,CYP3A4的影響會相對增強。因此瑞格列奈的代謝和清除可能會由於細胞色素酶P450的已知或誘導作用而發生改變。因此,與瑞格列奈同時使用CYP2C8和CYP3A4抑制劑時應格外謹慎。
一項在健康志願者中開展的藥物相互作用研究表明,CYP2C8抑制劑吉非貝齊(每日兩次,每次600mg)與瑞格列奈(單劑量0.25mg)同服,可是健康志願者血液中瑞格列奈AUC增加8.1倍,Cmax增加2.4倍,清除半衰期(t1/2)從1.3小時延長到3.7/小時。這可能導致瑞格列奈降糖作用增強及作用時間延長。
因此,應避免將吉非貝齊與瑞格列奈合用。如果必須合用,應嚴密監測患者的血糖水平,因為二者合用時可能需要減少瑞格列奈的用藥劑量。在同一研究中,瑞格列奈與吉非貝齊和CYP3A4抑制劑伊曲康唑合用顯示出更強的降糖作用,瑞格列奈AUC增加19.4倍,半衰期從1.3小時延長到6.1小時。
甲氧苄啶(每日兩次,每次160mg)是一種弱CYP2C8抑制劑,與瑞格列奈(單劑025mg)同服,可使瑞格列奈AUC,Cmax和生物半衰期有輕微的增加(分別為1.6倍,1.4倍和1.2倍),血糖水平增加無明顯的統計學差異。這些缺少藥效學結果的數據系根據瑞格列奈低劑量治療獲得。由於尚無瑞格列奈劑量高於0.25mg與甲氧苄啶劑量高於320mg的合用安全性數據,因此應避免將瑞格列奈與甲氧苄氨嘧啶合用。如果必須合用,應嚴密監測患者的血糖水平,並進行嚴密的臨床監測。
利福平是一種CYP3A4強誘導劑,也是CYP2C8誘導劑,在瑞格列奈的代謝過程中同時起誘導和抑制作用。使用利福平(600mg)先期治療7天,然後與瑞格列奈(單劑4mg)在第7天時合用,AUC降低了50%(這是誘導和抑制作用的共同結果)。在最後一次服用利福平24小時後服用瑞格列奈,瑞格列奈的AUC降低了80%(單獨誘導作用)。
利福平與瑞格列奈合用可能會降低瑞格列奈的用藥劑量,應嚴密監測患者在開始使用利福平(快速抑制)。增加劑量(混合抑制和誘導)和停用利福平(單獨誘導)以及停用利福平約1周后,其誘導作用消失時的血糖水平,並根據血糖水平調節瑞格列奈的使用劑量。
克拉黴素是一種CYP3A4強抑制劑,以每日兩次,每次250mg劑量與瑞格列奈(單劑0.25mg)同服,可使瑞格列奈的暴露量有微弱的增加(AUC增加1.4倍,Cmax增加1.7倍),血清胰島素AUC平均增值增加1.5倍(Cmax增加1.6倍)。
服用瑞格列奈(單次給藥4mg)的同時服用CYP3A4強抑制劑酮康唑(每日200mg),可在一定範圍內增加瑞格列奈的暴露量(AUC增加1.2倍,Cmax增加1.6倍),血糖變化低於8%。
瑞格列奈與西米替丁、硝苯地平或辛伐他汀合用,所有CYP3A4作用底物均未顯著改變瑞格列奈的藥代動力學參數。
在健康志願者中進行的藥物相互作用研究發現,瑞格列奈對地高辛、茶鹼和法華林的藥代動力學特性無影響。因此在與瑞格列奈聯合使用時,無需調整這些藥物的劑量。
在健康志願者中開展的一項藥代動力學研究表明,合用口服避孕藥(乙炔雌二醇/左炔諾孕酮)雖然會縮短瑞格列奈的達峰時間,但不會改變瑞格列奈的總生物利用度至相關臨床範圍。瑞格列奈對左炔諾孕酮的生物利用度沒有具臨床意義的影響,但不能排除對乙炔雌二醇的生物利用度的影響。
下列藥物可能增強和/或延長瑞格列奈的降血糖作用:
吉非貝齊,克拉黴素,酮康唑,伊曲康唑,甲氧苄啶,其他類型抗糖尿病藥物,單胺氧化酶抑制劑(MAO),非選擇性β受體阻滯劑,血管緊張素轉換酶(ACE)抑制劑,酒精以及促合成代謝的激素。
下列藥物可能減弱瑞格列奈的降血糖作用:
口服避孕藥,利福平,苯巴比妥和卡馬西平,噻嗪類藥物,皮質激素,達那唑,甲狀腺激素,奧曲肽和擬交感神經藥。
β受體阻滯劑會掩蓋低血糖症狀。當接受瑞格列奈治療的患者使用或停止使用這些藥物時,應密切監測患者血糖的變化。
藥物過量
一項在2型糖尿病患者中開展的臨床試驗中,每周增加瑞格列奈的服藥量,在超過6周的時間範圍內服藥量從4mg增加至20mg。患者每日4次在進餐時服藥。除與血糖降低相關的可預期的影響外,基本未出現不良事件。由於該研究中通過增加熱量攝取的方法以減少低血糖症狀的發生,因此藥物相對過量會可能表現為降糖作用的增大及出現低血糖症狀(頭暈、出汗、震顫、頭痛等)。一旦出現這些反應,應採取有效措施糾正低血糖(口服碳水化合物)。更嚴重的低血糖伴有癲癇、意識喪失和昏迷,這種情況下,應靜脈輸入葡萄糖。
藥理毒理
本品為短效口服降血糖藥。通過促進胰腺β細胞的胰島素分泌,降低血糖水平。其作用機理是通過與β細胞膜上的特定位點結合,關閉β細胞膜上的ATP-依賴性鉀通道,使β細胞去極化,導致其鈣通道開放,鈣的內流增加,從而促使胰島素分泌。
藥代動力學
瑞格列奈經胃腸道快速吸收、導致血漿藥物濃度迅速升高。服藥後1小時內血漿藥物濃度達峰值。然後血漿濃度迅速下降,4~6小時內被清除。血漿半衰期約為1小時。瑞格列奈與人血漿蛋白的結合大於98%。瑞格列奈幾乎全部被代謝,代謝物未見有任何臨床意義的降血糖作用。瑞格列奈及其代謝產物主要自膽汁排泄,很小部分(小於8%)代謝產物自尿排出。糞便中的原形藥物少於2%。
據國外文獻報導,對腎功能正常(CrCl]80mL/min)、伴有輕微和中度腎功能損傷(CrCl=40~80mL/min)和嚴重腎功能損傷(CrCl=20~40mL/min)的2型糖尿病患者給予單劑量瑞格列奈後的穩態藥動學做了比較。腎功能正常的患者與伴有輕微和中度腎功能損傷的患者間的AUC和Cmax相似(平均值分別為56.7ng/mL*hr和57.2ng/mL*hr;37.5ng/mL和37.7ng/mL)。伴有嚴重腎功能損傷的患者的AUC和cmax均大幅增加(分別為98.0ng/mL*hr和50.7ng/mL),但是這項研究僅僅表明瑞格列奈濃度與肌酐清除率(CrCl)之間存在微弱的關聯。伴有輕微和中度腎功能損傷的患者無需調整起始劑量。然而,伴有嚴重腎功能損傷的2型糖尿病患者的起始劑量應定為0.5mg,然後再謹慎地調整劑量。在肌酐清除率低於20mL/min以及需要血液透析的腎衰患者中的研究尚未開展過。
據國外文獻報導,在12名健康受試者和12名按照Child-Pugh分級和咖啡因清除率分級的慢性肝病患者中展開了一項單劑量、標籤公開的研究。與健康受試者相比,伴有中度至重度肝功能損傷的患者的瑞格列奈總體血藥濃度和游離瑞格列奈濃度要高,而且持續時間更長(健康受試者AUC:91.6ng/mL*hr;慢性肝病患者AUC:368.9ng/mL*hr;健康受試者(Cmax:46.7ng/mL;慢性肝病患者Cmax:105.4ng/mL)。AUC與咖啡因清除率之間存在統計學上的相關。患者組中沒有觀察到血糖譜上的差異。在接受普通劑量的情況下,肝功能損傷的患者瑞格列奈以及相關代謝物的血藥濃度要比健康受試者高。因此,對肝功能受損的患者使用瑞格列奈需謹慎。劑量調整之間的間隔期應該更長,以準確地評估藥物治療應答。
貯藏
遮光、密閉25℃以下保存。
包裝
鋁塑包裝,30片/板×1板/盒;
鋁塑包裝,30片/板×2板/盒。
有效期
24個月。
執行標準
YBH06132010
批准文號
(1)1.0mg 國藥準字H20103637
(2)2.0mg 國藥準字H20103638
生產企業
江蘇豪森藥業股份有限公司
核准日期
2010年11月04日