概念及公式
細菌煉銅目前都採用置換沉澱法用鐵把銅置換出來,此法適用於處理含雜質多而含銅少的溶液。
浸出液中所含雜質(鐵、鋁、鈣、鎂等元素的鹽類)的量是與海綿銅的質量間接地成反比的。其中最有害的雜質是三價鐵,因它極易被金屬鐵屑還原為硫酸亞鐵,每還原1公斤的三價鐵,就要消耗0.5公斤的金屬鐵。在整個置換過程中出現和消耗鐵的反應是:
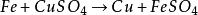 海綿銅
海綿銅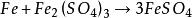 海綿銅
海綿銅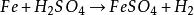 海綿銅
海綿銅第一個公式的反應速度比第二和第三的速度快得多,但第二公式和第三公式二個反應對置換過程是有害的,因此,一方面要儘量加快銅和鐵的反應,另一方面卻要儘量避免和控制酸及三價鐵與金屬鐵的反應。為此,浸取過程所用的浸礦劑(即經細菌氧化生成的硫酸高鐵)濃度不要太高,使流出的浸出液含少量的三價鐵為度。如果含三價鐵過多,則不可馬上置換沉澱銅,應先將此浸出液作為浸礦劑對新礦料再滲濾一次,然後再置換沉澱銅,這樣可充分發揮溶劑的作用。在某些場合下,也可預先使含三價鐵多的浸出液滲濾過黃鐵礦層,使其經受還原處理:
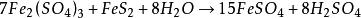 海綿銅
海綿銅或者將二氧化硫通入溶液中,也可使三價鐵還原為二價鐵:
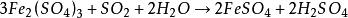 海綿銅
海綿銅用鐵置換含銅的浸出液時,應含有適當過量的游離硫酸。如果游離硫酸缺乏,酸度上升至pH=3時,則會使硫酸高鐵開始水解,從而析出不溶性的鹼式硫酸鐵和氫氧化鐵沉澱,反應式如下:
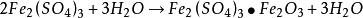 海綿銅
海綿銅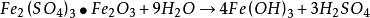 海綿銅
海綿銅同理,在這種情況下其它鹽類也會發生水解,生成氫氧化物一起被沉澱下來。一旦這種水解沉澱物形成後,即使在浸出液中再加入大量的酸也很難使其再溶解。這樣就會使海綿銅不純並降低其含銅品位,另方面又會使廢鐵屑的表面被沉澱物復蓋,致使廢鐵屑的化學活性降低。此外又浪費了大量的硫酸。
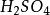 海綿銅
海綿銅但如果置換時硫酸過多(高於7克/升),會使廢鐵被硫酸溶解,致使它消耗量增大。根據一般經驗,使浸出液的酸度保持在pH=1.5左右(每升中含 。5—7克)為宜,這樣酸度的浸出液經置換沉澱銅後,pH一般上升到1.8或再稍高些,此時基本上不形成氫氧化鐵沉澱(如pH上升到2.0以上,則可加酸調回到pH=1.8左右)。這種置換銅後的廢液(即硫酸亞鐵溶液),又可直接用作細菌的營養物。
影響因素
(1)置換率與鐵用量的關係
置換海綿銅時需加的廢鐵屑,按照主要置換反應的理論消耗率計算,析出每一單位重量的銅需要0.874單位重量的鐵(即沉澱1噸金屬銅需874公斤純鐵)。實際上,由於廢鐵不純,加之被置換的浸出液還含硫酸高鐵與硫酸(它們均要與鐵發生反應而消耗廢鐵)以及操作過程中控制不當(如溶液的pH值超過1.8;置換時間控制不當和置換完全後處理產品的快慢),致使廢鐵的消耗量增大到每置換1單位重量的銅需要消耗1-2.5單位重量的廢鐵,有時甚至還要高一些。當然一般說來,鐵用得愈多,置換速度就愈快,銅置換就愈完全,這是由於鐵表面積增加及反應物質濃度的增加所致。
鐵屑的量對置換率的影響如右圖所示。
當鐵量少時,需要較長時間才能置換完全。如Fe:Cu=1:1.0及1.1:1時,需要4—5小時以上才置換得完全。當Fe:Cu為I1.6:1-1.8:1時,只需1小時就能置換完全。
(2)溶液中銅的濃度對置換速度的影響
當浸出液的含銅量位於0.6—15.0克/升之間時,含銅愈高,則置換速度愈快,置換率愈高,海綿銅的質量也隨之提高。但如果浸出液的含銅量達到或超過20克/升時,就會在鐵的表面迅速形成一層很難去掉的銅的外殼。因此,最好事先把其稀釋到15克/升以下再進行置換。
(3)溫度對置換率的影響
鐵對銅的置換反應在15—34℃的溫度範圍內,是隨溫度的增加而增加的。因為當溫度增加時,減低了溶液的粘度,增加離子的擴散速度,因而提高了反應物質的活性,加快了反應速度。置換反應通常是在離子擴散的情況下進行的,所以加溫對置換有很大的意義。
注意事項
(1)用作置換海綿銅的浸出液,事先要澄清沉澱一下,以除去因滲濾所帶下來的礦漿。其含銅量至少要在1克/升以上。
(2)高鐵(Fe“+)的濃度愈低愈好,置換時的酸硼度以pH=1.5—1.8為宜。如pH大於2以上,則必須及時力硫酸調回至pH=1.5—1.8。
(3)要用洗得很乾淨的廢鐵屑,其用量可稍過量。
(4)在置換過程中,要經常不斷地攪拌,以除去沉澱在鐵屑表面的海綿銅,使鐵屑不斷更新其表面,加快置換反應。在有條件的地方,最好採用通氣攪拌置換。例如:夏天通氣攪拌只要1—2小時就置換完畢,置換率達90一99%。而不通氣置換則需8—12小時,置換率僅達80—95%。
(5)置換速度與溫度成正比,所以冬天置換時最好通入熱蒸氣或熱空氣,置換速度就能大大地加快,所得的海綿銅質量也較高。
(6)判斷何時結束置換的方法有三個:①分析置換液中的含銅量至不再下降為止。通常是取一個用砂紙擦過的無鐵鏽的鐵釘,放入置換液20—30秒鐘後就取出,如沉澱在鐵釘上的海綿銅很少,則說明置換反應趨於結束,置換液中的含銅量已低於0.5克/升。②每隔一定時間取樣,通氣攪拌置換者每隔二、三十分鐘取一次,不通氣置換者每隔一小時取一次。肉眼觀察溶液顏色的變化,含銅量很高時呈深蘭色,含銅一般時呈蘭綠色,含銅低於0.5克/升時則呈現亞鐵的淺綠色。⑨每次取樣都測一下pH值有無變化,直到前後兩次取樣的pH值不變為止,即可認為置換反應已完全。
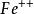 海綿銅
海綿銅(7)置換完全後,立即將置換廢液(即硫酸亞鐵廢液)排出,調整酸度及亞鐵( )濃度後,再用泵抽入細菌培養池供作細菌的培養物,以循環再生。將沉澱下來的海綿銅淘洗乾淨後,待稍乾,應立即放到產品庫,或放入缸中,用清水封閉,以防氧化。
最後,我們把海綿銅置於土坩堝中進行熔煉,鑄造成陽極板後,再用來進行土法電解,即可得99.9%以上的一級電解銅,這樣就能進一步滿足工農業生產對銅的需求。
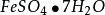 海綿銅
海綿銅另外,置換後的硫酸亞鐵廢液,除用作滿足細菌再生的營養物外,到一定時候尚有多餘時,則可將廢液濃縮到一定程度以後,得出含結晶的綠礬( )。它是一種工藝原料,可用於農業(殺蟲劑)、醫藥等部門,每噸價值200元左右。
熔煉
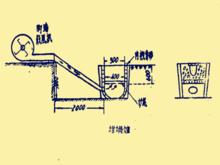 坩堝爐
坩堝爐海綿銅的熔煉使用坩堝,根據買到的坩堝每次可處理3.5~4公斤,熔煉時間40~50分鐘,用塊煤3~4公斤。
這種爐子構造簡單,在地上挖一個坑打一個鼓風口,用普通磚砌上爐襯即可(不放磚也可以)。
操作時先生著爐,以後放少量煤,底火形成後,放入烘好的坩蠍,坩堝燒紅後再加入銅粉,表面撒一層炭粉防止氧化,上面蓋上耐火磚,坩堝的周圍加上塊煤,鼓風40~50分鐘即可熔化,熔化後倒入模型。路子構造如右圖所示。
用途
海綿銅一般都是由含有雜質的硫酸銅溶液,在一定的酸度和一定的溫度等條件下,用鐵屑置換而得,因為置換出的銅粉比較疏鬆,故為海綿銅。剛置換的海綿銅比較活潑,容易被空氣中的氧氣所氧化,所以在海綿銅中存在一定量的氧化銅。另外在用鐵屑置換過程中,為使銅置換完全,必須加入過量的鐵屑,因此,在海綿銅中也存在一定量的雜質鐵。
一般海綿銅中,銅的含量在80%左右,主要是以金屬銅形式存在。用海綿銅為原料,採用碳酸氫銨一氨水混合溶液浸出時,海綿銅中的金屬銅和氧化銅均能溶解,以銅氨絡合物的形式進入溶液,而鐵則不與碳酸氫銨一氨水混合溶液發生反應,仍以固體沉澱留在殘渣中,固液分離後,使銅與鐵等氨不溶雜質得到很好分離。
用碳酸氨銨一氨水混合溶液浸出海綿銅時,固液比按1:3較為適宜,在不斷攪拌下,將海綿銅加人碳酸氫銨一氨水混合溶液中,同時向料液中鼓人空氣,開始階段進行常溫攪拌浸出,後期可將料液適當升溫(45℃左右,不要超過50℃),浸出結束後進行固液分離,其基本原理是:
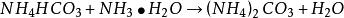 海綿銅
海綿銅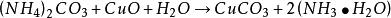 海綿銅
海綿銅由於氨具有加合作用:
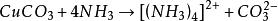 海綿銅
海綿銅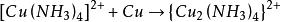 海綿銅
海綿銅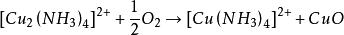 海綿銅
海綿銅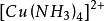 海綿銅
海綿銅由於形成的銅氨絡離子 在有過量存在是穩定的,當將銅氨絡合物溶液加熱把氨趕走後,銅氨絡合物就生成溶解度很小的鹼式碳酸銅沉澱析出。其基本原理是:
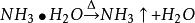 海綿銅
海綿銅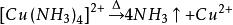 海綿銅
海綿銅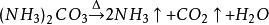 海綿銅
海綿銅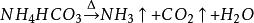 海綿銅
海綿銅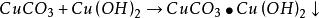 海綿銅
海綿銅由上述反應式可以看出,在趕氨脫銅過程中,會產生大量氣體逸出,如果控制不好,料液溫度升得過高,氣體泡沫上升過快,就會出現料液冒槽。因此,在加熱趕氨脫銅過程中,一定要警慎操作,並要備有溫度控制裝置,控制料液溫度不要升得過高,如果料液溫度升得過高,不但會出現料液冒槽,還會使生成的鹼式碳酸銅強熱分解,生成黑色的氧化銅,影響鹼式碳酸銅的產品質量,所以還須要備有補加冷液的裝置,這樣,當料液溫度升至一定高度,料液的泡沫上升過快時,及時補加冷液來調節料液的溫度。
另外還必須指出的是,當料液開始升溫的同時,就必須開動攪拌,絕不能等料液升至一定溫度時才開動攪拌,否則,攪拌一開動,會出現大量氣體突然逸出,造成料液冒槽。還有一點要指出的是,由於料液中存在一定量的亞銅氨絡合物,如果採用密閉加熱趕氨脫銅寸,在趕氨脫銅的初期,向料液中鼓人一定量的空氣,使這部分亞銅氨絡合物氧化生成銅氨絡合物。
在加熱趕氨脫銅過程中所逸出的大量氨氣必須回收循環使用,否則不但會造成原料的浪費,還會給大氣帶來污染。
趕氨脫銅的終點控制是以氨被趕淨為標準,可以採用濕的pH試紙檢測蒸出的蒸汽的pH值在7~7.5,說明料液中的氨已被趕淨,這時停止加熱,改通冷卻水進行攪拌冷卻,當料液的溫度降至室溫時,放料過濾,並用冷的純水洗滌濾餅,甩乾後烘乾即得成品鹼式碳酸銅。過濾的母液及洗水返回氨浸配料循環使用。

