簡介
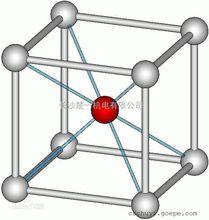 氯化銫結構
氯化銫結構氯化銫(Cesium chloride),化學式為CsCl,分子量為168.36。是一種無機鹽,無色立方晶體,密封陰涼乾燥保存。熔點645℃,沸點1290℃,相對密度3.988;易溶於水、乙醇、甲醇,不溶於丙酮。在空氣中吸濕潮解。氯化銫晶胞是素晶胞(可看成氯離子作簡單立方堆積,銫離子填充立方空隙)。採取這種晶體結構的化合物包括CsCl,CsBr,CsI,TlCl,TlBr和NHCl等。高於445℃,氯化銫也具有配位數8的面心立方結構 。
氯化銫合成方法
1、將碳酸銫溶解於少量水中。在不斷攪拌下慢慢加入相對密度為1.18的鹽酸,加熱反應:
CsCO+ 2 HCl → 2 CsCl + 2 HO + CO
當pH=3時,煮沸半小時加入氫氧化銫使溶液pH值到中性。過濾,濾液蒸發濃縮至大量結晶析出,冷至室溫,分離母液,潔淨與100ºC烘乾,即為成品。
2、用碳酸銫溶於鹽酸,再濃縮其溶液以製取氯化銫。通常可得到純度為99.5%的氯化銫,可直接使用。對不夠純淨的氯化銫,可採用下列方法精製。
將15g的氯化銫,加熱溶於100mL的水中。將化學計量24.2g氯化汞溶於25mL 4mol的鹽酸中。趁熱將此HgCl/HCl溶液加到上述溶液中,攪拌混合,冷卻,即可析出CsHgCl結晶。吸濾,收集結晶,棄去母液。將結晶溶於120mL的熱水中,冷卻後再次有結晶析出。為此反覆進行2~3次重結晶,鹼金屬可降至0.01%以下,最後將結晶溶於熱水,通入HS氣體使溶液達到飽和,就有HgS沉澱析出,濾去HgS,收集濾液,蒸發至乾,即可得純淨的氯化銫 。
氯化銫相關計算數據
1、疏水參數計算參考值(XlogP):無
2、氫鍵供體數量:0
3、氫鍵受體數量:1
4、可旋轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積:0
7、重原子數量:2
8、表面電荷:0
9、複雜度:2
10、同位素原子數量:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
13、確定化學鍵立構中心數量:0
14、不確定化學鍵立構中心數量:0
15、共價鍵單元數量:2

