泰勒效應
以d9、 Cu2+的配合物為例,當該離子的配合物是正八面體構型時,d軌道就要分裂成t2g和EG二組軌道, 設其基態的電子構型為t2g6e2g3,那么三個eg電子就有兩種排列方式:
 姜-泰勒效應
姜-泰勒效應①t2g6(dz2)2(dx2-y2)1,由於dx2-y2軌道上電子比dz2軌道上的電子少一個, 則在xy平面上d電子對中心離子核電荷的禁止作用就比在z軸上的禁止作用小,中心離子對xy平面上的四個配體的吸引就大於對z軸上的兩個配體的吸引, 從而使xy平面上的四個鍵縮短, z軸方向上的兩個鍵伸長,成為拉長的八面體。
②t2g6(dz2)1(dx2-y2)2 由於dz2軌道上缺少一個電子, 在z軸上d電子對中心離子的核電荷的禁止效應比在xy平面的小, 中心離子對 z軸方向上的兩個配體的吸引就大於對xy平面上的四個配體的吸引, 從而使z軸方向上兩個鍵縮短, xy面上的四條鍵伸長, 成為壓扁的八面體.無論採用哪一種幾何畸變, 都會引起能級的進一步分裂, 消除簡併, 其中一個能級降低, 從而獲得額外的穩定化能。這也就是為什麼銅離子經常形成平面四方形(其實就是拉長的八面體)的配合物的原因之一。
泰勒效應
姜-泰勒效應不能指出究竟應該發生哪種幾何畸變,但實驗證明,Cu的六配位配合物,幾乎都是拉長的八面體,這是因為, 在無其他能量因素影響時,形成兩條長鍵四條短鍵比形成兩條短鍵四條長鍵的總鍵能要大之故。
對於具有六配位的過渡金屬離子來說,其中d0、d3、d5、d10以及高自鏇的d5和低自鏇的d8離子,它們之中被電子所占據的各個軌道疊合在一起時,所表現出來的整個d殼層電子云在空間的分布,將符合Oh對稱,因此它們在正八面體配位位置中是穩定的。但其他離子,特別是d9和d4離子,它們d殼層電子云的空間分布不符合Oh對稱,因此它們在正八面體配位位置中是不穩定的,從而將導致d軌道的進一步分裂,並使配位位置發生偏離Oh對稱的某種畸變,以便使中心離子穩定。這種由於中心過渡金屬離子之d電子云分布的對稱性和配位體的幾何構型不相協調,因而導致後者發生畸變,並使中心陽離子本身的d軌道的簡併度降低,以便達到穩定化程度提高,這種效應稱為姜-泰勒效應,或稱畸變效應。
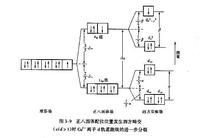
現以Cu2+(3d9)離子為例來說明上述效應。Cu2+離子在八面體晶體場中的電子構型為(t2g)6(eg)3,與呈Oh對稱的d10殼層相比,缺少一個eg電子。如所缺的為dx2-y2軌道中的一個電子,那么,與d10殼層的電子云密度相比,d9離子在xy平面內的電子云密度就要顯得小一些。於是,有效核正電荷對位於xy平面內的四個帶負電荷的配位體的吸引力,就大於對z軸上的兩個配位體的吸引力,從而形成xy平面內的四個短鍵和z軸方向上的兩個長鍵,使配位正八面體畸變成沿z軸拉長了的配位四方雙錐體。這種情況就相當於,在八面體晶體場中,位於xy平面內的四個配位體向著中心的Cu2+離子靠近,同時z軸方向的兩個配位體則背離了中心離子向外移動,此時按照相同於圖3-8中所考慮的因素,原來是雙重簡併的eg軌道,便分裂為兩個能級;同時,三重簡併的t2g軌道也將發生相應的進—步分裂,最終導致如圖3-9所示的情況。此時,由於能級最高的 軌道中只有一個電子,因而與在正八面體場中的情況相比,中心陽離子將額外得到(1/2)β的穩定化能,從而得以在此畸變了的尖四方雙錐形配位位置中穩定下來。如果上述所缺少的一個eg電子不是dx2-y2軌道而是dz2軌道中的電子時,則畸變的結果將形成由四個長鍵和兩個短鍵所構成的扁四方雙錐形配位體。其他形式的畸變,它們的具體情況雖然各不相同,但機理都是一樣的。
一般來說,姜-泰勒效應的發生使得金屬離子顯得更“軟”,與配體結合時更傾向於共價鍵而不是離子鍵,所得的配合物在水溶液中溶解度減小(水本身是“硬”鹼(根據路易斯軟硬酸鹼理論)),而在弱極性有機溶劑(如乙醚,乙酸乙酯)中溶解度顯著增大(如氯化銅不僅易溶於水,而且易溶於乙醚和乙酸乙酯)。
泰勒效應
①Cu2+經常形成平面四方形化合物,而不是常見的四面體結構的化合物。
②氯化亞銅可以吸收一氧化碳,故在催化上有廣泛的套用。
③Pt2+經常形成平面四方形的化合物,其中順鉑是一種套用廣泛的抗癌藥。
④Co2+,Ni2+,Cu2+可以形成穩定的Salen化合物(平面四方形配位),該化合物易溶於醚,乙酸乙酯,在催化領域和配位化學上有重要的意義。