血紅蛋白
血紅蛋白(haemoglobin;hemoglobin;ferrohemoglobin;Hb;HHb ) 每一血紅蛋白分子由四分子的珠蛋白和四分子亞鐵血紅素組成,珠蛋白約占96%,血紅素占4%。
α和β都類似於肌紅蛋白,只是肽鏈稍短:α亞基為141aa;β亞基為146aa。α和β亞基隔著一個空腔彼此相向。
在哺乳動物中,血紅蛋白占紅細胞乾重的97%、總重的35%。平均每克血紅蛋白可結合1.34ml的氧氣,是血漿溶氧量的70倍。
組成結構
血紅蛋白是高等生物體內負責運載氧的一種蛋白質。也是紅細胞中唯一一種非膜蛋白。人體內的血紅蛋白由四個亞基構成,分別為兩個α亞基和兩個β亞基,在與人體環境相似的電解質溶液中血紅蛋白的四個亞基可以自動組裝成α2β2的形態。血紅蛋白的每個亞基由一條肽鏈和一個血紅素分子構成,肽鏈在生理條件下會盤繞摺疊成球形,把血紅素分子抱在裡面,這條肽鏈盤繞成的球形結構又被稱為珠蛋白。血紅素分子是一個具有卟啉結構的小分子,在卟啉分子中心,由卟啉中四個吡咯環上的氮原子與一個亞鐵離子配位結合,珠蛋白肽鏈中第8位的一個組氨酸殘基中的吲哚側鏈上的氮原子從卟啉分子平面的上方與亞鐵離子配位結合,當血紅蛋白不與氧結合的時候,有一個水分子從卟啉環下方與亞鐵離子配位結合,而當血紅蛋白載氧的時候,就由氧分子頂替水的位置。
功能
血紅蛋白是脊椎動物紅血細胞的一種含鐵的複合變構蛋白,由血紅素和珠蛋白結合而成。其功能是運輸氧和二氧化碳,維持血液酸鹼平衡。也存在於某些低等動物和豆科植物根瘤中。分子量約67 000,含有四條多肽鏈,每個多肽鏈含有一個血紅素基團,血紅素中鐵為二價,與氧結合時,其化學價不變,形成氧合血紅蛋白。呈鮮紅色,與氧解離後帶有淡藍色。有多種類型:血紅蛋白A(HbA),α2β2,占成人血紅蛋白的98%;血紅蛋白A2(HbA2),α2δ2,占成人血紅蛋白的2%;血紅蛋白F(HbF),α2γ2,僅存在於胎兒血中;血紅蛋白H(HbH),β4,四個相同β鏈組成的四聚體血紅蛋白;血紅蛋白C(HbC),β鏈中Lys被Glu取代的血紅蛋白;血紅蛋白S(HbS),鐮刀狀細胞紅蛋白;血紅蛋白O2(HbO2,HHbO2),氧合血紅蛋白;血紅蛋白CO(HbCO),一氧化碳結合血紅蛋白。在沒有氧存在的情況下,四個亞基之間相互作用的力很強。氧分子越多與血紅蛋白結合力越強。中心離子鐵(II)進一步和蛋白質鏈中的組氨酸結合,成為五配位。既是配位中心,又是活性中心。血紅蛋白中鐵(II)能可逆地結合氧分子,取決於氧分壓。它能從氧分壓較高的肺泡中攝取氧,並隨著血液循環把氧氣釋放到氧分壓較低的組織中去,從而起到輸氧作用。一氧化碳與血紅蛋白的結合較氧強,即使濃度很低也能優先和血紅蛋白結合,致使通往組織的氧氣流中斷,造成一氧化碳中毒(使氧氣與血紅蛋白的結合能力下降,使人窒息而死亡)。
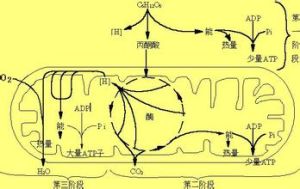 呼吸酶
呼吸酶