相關定義
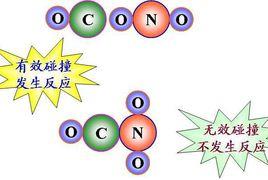
有效碰撞
 有效碰撞
有效碰撞反應物分子間必須相互碰撞才有可能發生反應,但不是每次碰撞都能發生反應。在化學上,把能夠發生反應的碰撞稱為有效碰撞。 有效碰撞必須滿足兩個條件:(1)是發生碰撞的分子具有較高的能量;(2)是分子在一定方向上發生碰撞。
活化分子和活化能
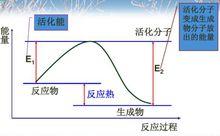 活化能的表示
活化能的表示在化學反應中,能量較高,有可能發生有效碰撞的分子成為活化分子。
活化分子的平均能量與普通反應物分子的平均能量的差值成為活化能。
提出過程
化學反應碰撞理論是在氣體分子動理論的基礎上於20世紀初發展起來的。1918年,路易斯運用氣體分子動理論的成果,以分子碰撞的觀點來判斷化學反應的發生與否,提出了化學反應的有效碰撞理論。
基本內容
反應物分子的碰撞接觸是發生化學反應的先決條件,但並不是每一次碰撞都能導致反應發生,發生有效碰撞必須滿足兩個條件:(1)能量因素,即反應物分子的能量必須達到某一臨界值;(2)空間因素,活化分子必須按照一定的方向相互碰撞反應才能發生。即反應物分子必須具備克服分子斥力而“碰到一起”得能量,也就是具備反應物分子之間發生“非彈性碰撞”的能量;活化分子必須按照一定的方向相互碰撞,即需要考慮活化分子發生碰撞的空間因素。
在化學反應速率影響因素分析中的套用
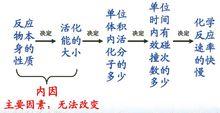 化學反應碰撞理論與化學反應速率分析
化學反應碰撞理論與化學反應速率分析化學反應碰撞理論說明:(1)活化分子的碰撞不一定都是有效碰撞;(2)活化分子數越多,有效碰撞次數就越多,反應速率就越快。因此,化學反應速率快慢可根據濃度、壓強、溫度、催化劑等不同因素對活化分子發生有效碰撞次數的影響來判斷。
濃度對化學反應速率的影響
分析:其他條件不變,增大反應物濃度→單位體積內活化分子數增多→單位時間內有效碰撞次數增多→反應速率增大。
結論:其他條件不變,增大反應物濃度,反應速率加快;減小反應物濃度,反應速率減慢。
注意事項:(1)此規律只適用於氣體反應或溶液中的反應,對於純液體或固體反應物一般情況下其濃度是常數,因此改變他們的量不會改變化學反應速率。(2)化學反應為可逆反應,反應物或生成物濃度的改變,其正反應速率或逆反應速率的變化也符合上述規律。
壓強對化學反應速率的影響
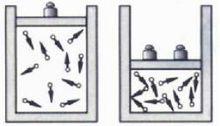 壓強對化學反應速率的影響
壓強對化學反應速率的影響分析:其他條件不變,增大壓強(減小容器容積)→單位體積內活化分子數增多→單位時間內有效碰撞次數增多→反應速率增大。
結論:其他條件不變,增大壓強(減小容器容積),反應速率加快;減小壓強(增大容器容積),反應速率減慢。
注意事項:(1)壓強對固體和液體(溶液)間的反應無影響。(2)對於有氣體參加的可逆反應,增大壓強,正反應速率、逆反應速率都增大;減小壓強,正反應速率、逆反應速率都減小。(3)注意“真”變和“假”變。若體系的壓強變化而使反應物或生成物的濃度變化即“真”變,否則是“假”變。
溫度對化學反應速率的影響
分析:(1)其他條件不變,溫度升高→分子獲得更高的能量→單位時間內有效碰撞次數增多→反應速率增大。(2)其他條件不變,溫度升高→碰撞頻率提高→單位時間內有效碰撞次數增多→反應速率增大。
結論:其他條件不變,升高溫度,反應速率加快;降低溫度,反應速率減慢。
注意事項:(1)一般溫度每升高10℃,化學反應速率增大到2-4倍;(2)溫度對化學反應速率的影響規律,對吸熱反應、放熱反應都適用。(3)反應若是可逆反應,升高溫度,正、逆反應速率都加快;降低溫度。正逆反應速率都減慢。
催化劑對化學反應速率的影響
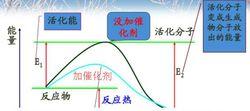 催化劑對化學反應速率的影響
催化劑對化學反應速率的影響分析:使用催化劑時,使發生反應所需的活化能降低,這樣會使更多的反應物分子成為活化分子,大大增加單位體積內反應物分子中活化分子所占的百分數,從而使有效碰撞的幾率提高,因而使反應速率加快。
結論:其他條件不變,加入正催化劑,反應速率加快;加入負催化劑,反應速率減慢。(沒說明時通常指正催化劑。)
注意事項:(1)同一催化劑能同等程度的改變化學反應速率。(2)催化劑只能改變反應速率,不能將不反應變成反應。(3)催化劑有一定的選擇性和活化溫度。
其他影響因素
固體顆粒大小、光、電、射線等。
理論基礎
在化學反應碰撞理論之前,先後提出物體碰撞理論、氣體分子碰撞理論,它們是化學反應碰撞理論的基礎。
物體碰撞理論
物體運動是物體發生碰撞的前提,物體碰撞是物體運動狀態發生變化的前提。
物體的碰撞按照能量因素可分為彈性碰撞和非彈性碰撞,按照空間因素可分為對心碰撞和非對心碰撞。如果碰撞過程中機械能守恆,這樣的碰撞叫做彈性碰撞;如果碰撞過程中機械能不守恆,這樣的碰撞叫做非彈性碰撞。如果物體碰撞後粘合在一起或者運動速度完全相同,碰撞過程中碰撞系統的動能損失最大,這樣的碰撞叫做完全非彈性碰撞。
在彈性碰撞中,碰撞系統遵守動量守恆和機械能守恆。在非彈性碰撞中,碰撞系統依然遵守動量守恆,但在碰撞過程中碰撞系統的動能會轉化為系統的內能等其他形式的能量,所以碰撞系統的機械能不再守恆。並且,完全非彈性碰撞中動能轉化為內能等其他形式能量的量最大。
氣體分子碰撞理論
分子運動是分子發生碰撞的前提,分子彈性碰撞是分子運動的重要特徵之一,分子運動的特徵又是物質巨觀屬性的微觀實質。
氣體分子碰撞理論作為分子動理論的重要組成部分,它以“物體是由大量的分子組成的,分子在做永不停息的無規則運動,分子之間存在著引力和斥力”為前提,其主要內容包括:
(1)氣體分子熱運動可以看作是在慣性支配下的自由運動。由於氣體分子之間距離很大,而分子力的作用範圍又很小,因此,除分子與分子、分子與器壁相互碰撞的瞬間外氣體分子間相互作用的分子力是極其微小的;又由於重力的作用一般可以忽略,所以氣體分子在相鄰兩次碰撞之間的運動可以看作是在慣性支配下的自由運動。
(2)氣體分子間碰撞是在分子力作用下的散射過程。當分子與分子相互靠攏以至彼此相距極近(10 m)時分子間的相互作用表現為斥力,且這種斥力隨著分子間距的進一步減小而急劇地增大,在這樣強大斥力作用下,分子與分子又重新分開,這就是所謂的分子碰撞的物理過程。
(3)氣體分子之間的碰撞遵守動量守恆和機械能守恆。由於氣體分子之間的碰撞是“彈性碰撞”,碰撞過程必然遵守動量守恆和機械能守恆。