詳解
共聚焦雷射掃描顯微(英語: Confocal laser scanning microscopy, CLSM, LCSM)是一項高解析度三維光學成像技術。主要特點在於其光學分層能力,即獲得特定深度下焦點內的圖像。圖像通過逐點採集,以及之後的計算機重構而成。因此它可以重建拓撲結構複雜的物體。對於不透明樣品,可以進行表面作圖,而對於透明樣品,則可以進行內部結構成像。內部結構成像上,圖像質量在單台顯微鏡中就可以得到極大的提升,因為來自樣品不同深度的信息未被重疊。傳統顯微鏡能“看”到所有能被光投身到地方,而對於共聚焦顯微鏡,只有焦點處的信息被採集。實際上共聚焦雷射掃描顯微是通過對焦點深度的控制和高度限制來實現的。
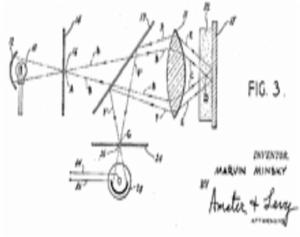
共聚焦的原理早在1957年就由美國科學家馬文·明斯基註冊為專利,但實際上經過三十年的時間及相應專用雷射器的發展,直至1980年代末這項技術才成為標準技術。1978年,托馬斯和克里斯托弗·克萊默設計出一套雷射掃描程式。該程式採用雷射聚焦的方式逐點掃描物體三維表面,並通過類似於掃描電鏡的計算機化手段生成圖像。這一共聚焦雷射掃描顯微設計首次結合了雷射掃描方法和螢光標記的生物樣品三維探測。接下來的數十年內,共聚焦螢光顯微發展成一項成熟的技術,尤其受益於阿姆斯特丹大學(University of Amsterdam),來自海德堡的歐洲分子生物實驗室(European Molecular Biology Laboratory)及其業界夥伴的共同努力。
共聚焦顯微鏡提供了完整,厚實,活體標本的直接,無創,連續光學切片的能力,最小化樣品製備以及橫向解析度的微小改善。生物樣品通常用螢光染料處理,以使選定的物體可見。然而,實際的染料濃度可以很低,以最小化生物系統的干擾:一些儀器可以跟蹤單個螢光分子。此外,轉基因技術可以產生生成其自身螢光嵌合分子的生物(例如GFP,綠色螢光蛋白的融合體)用感興趣的蛋白質)。共聚焦顯微鏡的工作原理是樣品中的點激發(衍射極限點)和所得螢光信號的點檢測。探測器上的針孔提供了阻擋離焦螢光的物理屏障。僅記錄通風盤的對焦或中心點。光柵一次掃描一個樣本允許通過簡單地改變z焦點來收集薄的光學部分。可以堆疊所得到的圖像以產生樣本的3D圖像。
用於水平掃描的顯微技術
市面上有四種類型的共焦顯微鏡:
共聚焦雷射掃描顯微鏡使用多個鏡子(通常沿x軸和y軸線性掃描2或3個)來掃描樣品上的雷射,並通過固定的針孔和檢測器“掃描”圖像。
旋轉盤( Nipkow盤 )共焦顯微鏡在盤上使用一系列移動針孔來掃描光點。由於一系列針孔平行掃描一個區域,因此與雷射掃描顯微鏡相比,允許每個針孔在特定區域上懸停更長的時間,從而減少照射樣品所需的激發能量。降低的激發能量減少了樣品的光毒性和光漂白,使其成為用於成像活細胞或生物體的優選系統。
微透鏡增強或雙旋轉盤共聚焦顯微鏡的工作原理與旋轉盤共聚焦顯微鏡相同,只是在含有針孔的旋轉盤之前放置含有微透鏡的第二個旋轉盤。每個針孔都有一個相關的微透鏡。微透鏡用於捕獲寬頻光並將其聚焦到每個針孔中,從而顯著增加引入每個針孔的光量並減少旋轉盤阻擋的光量。因此,微透鏡增強型共聚焦顯微鏡比標準旋轉磁碟系統更敏感。橫河電機於1992年發明了這項技術。
可程式陣列顯微鏡(PAM)使用電子控制的空間光調製器(SLM),產生一組移動的針孔。SLM是包含像素陣列的設備,其具有可以電子調整的各個像素的一些屬性(不透明度,反射率或旋光度)。SLM包含微機電鏡或液晶組件。圖像通常由電荷耦合器件(CCD)相機獲取。
這些類共焦顯微鏡中的每一種都具有特定的優點和缺點。大多數系統要么針對記錄速度(即視頻捕獲)或高空間解析度進行了最佳化。共聚焦雷射掃描顯微鏡可以具有可程式的採樣密度和非常高的解析度,而Nipkow和PAM使用由相機解析度定義的固定採樣密度。單點雷射掃描系統的成像幀速率通常比旋轉磁碟或PAM系統慢。商用旋轉盤共聚焦顯微鏡的幀速率超過每秒50幀- 這是動態觀察(如活細胞成像)的理想特徵。
在實踐中,只要針孔距離足夠遠,Nipkow和PAM就允許多個針孔平行掃描同一區域。
共焦雷射掃描顯微鏡的前沿開發現在通過使用多個微機電掃描鏡,可以比標準視頻速率(每秒60幀)成像更好。
共聚焦X射線螢光成像是一種較新的技術,除了水平和垂直瞄準外,還可以控制深度,例如,在分析繪畫中的埋藏層時。