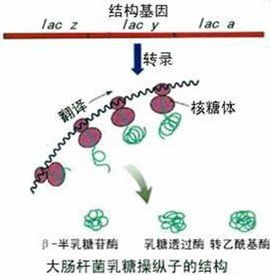
結構
細菌相關功能的結構基因常連在一起,形成一個基因簇。它們編碼同一個代謝途徑中的不同的酶。一個基因簇受到同一的調控,一開俱開,一閉俱閉。也就是說它們形成了一個被調控的單位,其它的相關功能的基因也包括在這個調控單位中,例如編碼透過酶的基因,雖它的產物不直接參與催化代謝,但它可以使小分子底物轉運到細胞中。
乳糖分解代謝相關的三個基因,lacZ、Y、A就是很典型的是上述基因簇。它們的產物可催化乳糖的分解,產生葡萄糖和半乳糖。它們具有順式作用調節元件和與之對應的反式作用調節因子。三個結構基因圖的功能是:
lacZ編碼β-半乳糖苷酶(β-galactosidase),此酶由500kd的四聚體構成,它可以切斷乳糖的半乳糖苷鍵,而產生半乳糖和葡萄糖
lacY編碼β一半乳糖苷透性酶(galactoside permease),這種酶是一種分子量為30kDd膜結合蛋白,它構成轉運系統,將半乳糖苷運入到細胞中。
lacA編碼β-硫代半乳糖苷轉乙醯基酶(thiogalactoside transacetylase),其功能只將乙醯-輔酶A上的乙醯基轉移到β-半乳糖苷上。
無論是lacZ發生突變還是lacY發生突變卻可以產生lac-型表型,這種lac-表型的細胞不能利用乳糖。 lacZ-突變體中半乳糖苷酶失去活性,直接阻止了乳糖的代謝。lacY-突變體不能從膜上吸取乳糖。
這一個完整的調節系統包括結構基因和控制這些基因表達的元件,形成了一個共同的調節單位,這種調節單位就稱為操縱子(opron)。操縱子的活性是由調節基因控制的,調節基因的產物可以和操縱子上的順式作用控制元件相互作用。
lacZ、Y、A基因的轉錄是由lacI基因指令合成的阻遏蛋白所控制。lacI一般和結構基因相毗連,但它本身具有自己的啟動子和終止子,成為獨立的轉錄單位。由於lacI的產物是可溶性蛋白,按照理說是無需位於結構基因的附近。它是能夠分散到各處或結合到分散的DNA位點上(這是典型的反式-作用調節物。)
通過突變的效應是可以將結構基因和調節基因相區別的,結構基因發生突變,細胞中就失去這些基因合成的蛋白。但是調節基因發生突變會影響到它所控制的所有結構基因的表達。調節蛋白的突變的結果可以顯示調節的類型。
lac基因簇是受到負調節(negative regulation)。它們的轉錄可被調節蛋白所關閉。若調節蛋白因突變而失活就會導致結構基因組成型表達。表明調節蛋白的功能是阻止結構基因的表達,因此稱這些蛋白為“阻遏”蛋白。
乳糖操縱子的阻遏蛋白是由4個亞基(38kDa)組成的四聚體。一個野生型細胞中大約有10個四聚體。調節基因轉錄成單順反子的mRNA,它和操縱子的比率與RNA聚合酶和啟動子之比是相似的。
lac I的產物稱為lac阻遏物(lac repressor),其功能是和lacZ、Y、A基因簇5′端的操縱基因(lac O),操縱基因位於啟動子(lac P)和結構基因(lac ZYA)之間。當阻遏物結合在操縱基因上時就阻礙了啟動子上的轉錄起始。lac O 從mRNA轉錄起始點的上游-5處延伸到轉錄單位+21處。這樣它和啟動子的末端發生重疊。新近的觀點認為阻遏物影響了RNA聚合酶,從操縱基因和啟動子二者相關位置來看阻遏物結合在DNA上會阻礙RNA聚合酶轉錄結構基因。但我們必須注意其它一些操縱子上的操縱基因其位置和乳糖操縱子並不相同,因而阻遏蛋白可以通過多種方式與操縱操縱基因結合阻斷轉錄。
發展
阻遏蛋白的活性受到小分子誘導的控制
細菌對環境的改變必需作出迅速的反應。營養供給隨時都可能發生變化,反覆反常。要能得以倖存必需具有可以變換不同代謝底物的能力。單細胞真核生物也同樣生活在不斷變化環境中;而更為複雜的多細胞生物都具有一套恆定的代謝途徑,而無需對外部環境作出反應。
在細菌中是很需要靈活性,也需要很經濟,因為細菌遇到合適的環境就大量消耗營養對其本身也是不利的。在缺乏底物時就不必要合成大量相關的酶類,因此細菌產生了一種調節機制,即在缺乏底物時就阻斷酶的合成途徑,但同時又作好了準備,一旦有底物存在就立即合成這些酶。
特殊底物的存在導致了酶的合成,此現象稱為誘導(induction)。這種類型的調控廣泛存在於細菌中,在較低等的真核生物(如酶母)也有這種情況。E.coli的乳糖操縱子提供了這種調控機制的典型範例。
當E.coli生長在缺乏β一半乳糖苷的條件下是不需要β-半乳糖苷酶的,因此細胞中含量很低,大約每個細胞不高於5個分子,當加入底物後細菌中十分迅速地合成了這種酶,僅在2-3分鐘之內酶就可以產生並很快增長到5000個分子/每個細胞。如在酶的濃度將達到細胞總蛋白的5-10%。如在培養基中除去底物,那么酶的合成也就迅速停止,恢復到原來的狀態。
如果原來培養基中無乳糖,也無葡萄糖,那么細胞只在很低的基本水平合成β-半乳苷酶和透性酶。當加入Lac後,Ecoli的lac+ 細胞很快大量合成以上兩種酶。進一步用32P標記mRNA作雜交實驗(用λlac中的取得的DNA,與加入乳糖後不同時間內產生的32P-mRNA進行分子雜交)結果表明加入的乳糖能激發lac的mRNA的合成。lac mRNA極不穩定,其半衰期僅有3分鐘,這個特點隨著誘導很快的恢復。當誘導物一除去轉錄立即停止,在很短的時間內所有的lac mRNA即被降解掉,細胞內的含量恢復到基礎水平。
β-半乳糖苷酶和透性酶合成是和lac mRNA同時被誘導的,但當除去誘導物時在細胞中β-半乳糖苷酶和透性酶要比lac mRNA穩定,因此酶的活性在一段較長的時間內保持被誘導水平。這種對營養供給發生改變作出迅速反應的調控類型,不僅提供了代謝新底物的能力,而且習慣於關閉在培養基中實然加入的一些成份的內部合成。比如E.coli的Trp的合成是通過Trp合成酶的作用。如果在細菌生長的培養基中加入Trp的話,那么立即停止Trp合成酶的生產。這種作用稱為阻遏(repression)效應。它使細菌避免合成多餘的物質。
在細菌中同時存在著誘導和阻遏的現象。誘導是細菌調節其分解底物供給生長的能力。阻遏是細菌調節其合成代謝產物的能力。無論是酶作用的小分子底物的調節,還是酶活性的產生,它們的啟動是獨自的,小分子底物稱為誘導物(inducers)某些物質能阻止酶合成它們本身,此物質就稱輔阻遏物(corepressors)。
誘導和酶阻遏是高度特異的,只有底物/產物或緊密相關的分子才能起作用,但小分子的活性並不依賴於和靶酶的相互作用。某些誘導物與自然的β-半乳糖苷酶相似,但並不能被酶分解,比如異丙基-β-D-硫代半乳糖苷(isopropylthiogalactoside,IPTG)。其半乳糖苷鍵中用硫代替了氧,失去了水解活性,但硫代半乳糖苷和同源的氧代化合物與酶位點的親和力相同,IPTG雖不為β-半乳糖苷酶所識別,但它是lac基因簇十分有效的誘導物。
能誘導酶的合成,但又不被分解的分子,稱為安慰誘導物(gratuitous inducer)。由於乳糖雖可誘導酶的合成,但又隨之分解,產生很多複雜的動力學問題,因此人們常用安慰誘導物來進行各種實驗。它的存在表明一個重要的問題,就是這個控制系統必須具有某種成份,它不同於靶酶,能識別合適的底物;而它的這種識別相關底物的能力也不同於酶。
對誘導物作出反應的這種成份就是阻遏蛋白,它由lacI編碼,其作用是控制lacIYA結構基同的轉錄,對環境作出反應。三個結構基因轉錄成單個的多順反子mRNA。阻遏蛋白的活性狀態決定了此啟動子是否打開或關閉。在缺乏誘導物時,這些基因不能轉錄,因為阻遏蛋白是活性狀態結合在操縱基因上。當誘導物存在時,阻遏物與之結合,變成為失活狀態,離開操縱基因,啟動子開始轉錄,起始於lacZ 5¢端,終止於lacA的3¢端。
誘導物如何控制阻遏蛋白的活性呢?阻遏物對於操縱基因有很高的親和性,在缺乏誘導物時,阻遏物總是結合在操縱基因上,使得鄰近的結構基因不能轉錄。但當誘導物存在時,它和阻遏物結合形成了一個阻遏物複合體,不再和操縱基因結合。
 乳糖操縱子
乳糖操縱子右圖為Lac操縱子(Lac operon)的結構以及負調控圖:
(a)Lac操縱子的結構圖
(b)無誘導物存在時,阻遏物與操作基因(operator)結合使得結構基因不能正常轉錄
(c)誘導物(乳糖或IPTG)存在,與阻遏物結合時阻遏物從操縱基因上下來,RNA聚合酶可通過啟動子和操作基因正常轉錄出一條多順反子mRNA從可翻譯得到三種酶操縱子控制的重要特性是阻遏物的雙重性:它既能阻止轉錄,又能識別小分子誘導物。阻遏物有2個結合位點:一個是結合誘導物的,另一個是結合操縱基因的。當誘導物在相應位點結合時,它改變了阻遏蛋白的構象,干擾了另一位點的活性。這種類型的調控叫變構調控。(allosteric control)
誘導完成一種協同調控(coordinate regulation):所有的一組基因都一道表達或一道關閉。mRNA一般總是從5¢開始轉錄,所以誘導總是導致β-半乳糖苷酶,Lac透性酶和Lac乙醯轉移酶按一定順序出現。此多順反子mRNA的共同轉錄解釋了為什麼在誘導物的不同條件下,lacZ、Y、A三個基因的產物總保持同樣的當量關係。
誘導觸動了“開關”使基因簇表達。誘導物交替變換它們的效應,其它的因子影響了轉錄和翻譯的絕對水平,但三個基因之間的關係事先已被它們的結構所決定了。
我們要注意操縱子的潛在特點。Lac操縱子含有lacZ,它編碼糖代謝所必須的β-半乳糖苷酶;含有的lac編碼透性酶,此酶是負責將底物轉達運到細胞中。但操縱子在非誘導狀態時,基因尚未表達,也就不存在透性酶。那么誘導物開始怎樣進入細胞呢?
其實在細胞中透過酶等總是以最低量存在的,足以供給底物開始進入之需。操縱子有一個本底水平(basal level)的表達,即使沒有誘導物的存在,它也保持此表達水平(誘導水平的0.1%),而有的誘導物是通過其它的吸收系統進入細胞的。
鑑別
操縱基因和調節基因的鑑別
野生型的操縱子以被調節的方式進行表達,調節系統若發生突變可能使表達停止或者在沒有誘導物存在時仍然表達。前者稱為不可誘導性(uninducible)突變;後者對調節沒有反應能力,無論誘導物是否存在都進行表達,故稱為組成型突變(constitutive mutants)。
操縱子調節系統的成份通過突變已被鑑別出來,它們作用於結構基因的表達以及編碼區的外側序列。這些成份分為二類:以啟動子和操縱子,作為調節蛋白(RAN聚合酶,阻遏物)靶順序的通過順式作用突變而被鑑定出來。lac位點通過反式作用突變被鑑定是為編碼阻遏蛋白的基因。
操縱基因是原來通過組成型突變鑑別出的,稱為“Oc”,其分布特點提供了第一個順式元件的證據,它是有功能的,但本身不編碼。與OC突變相鄰接的結構基因以組成型表達,這是由於突變改變了操縱基因,使阻遏蛋白不能與之結合。這樣阻遏蛋白就不能阻止RNA聚合酶起始轉錄。從而使操縱子持續轉錄。
操縱基因只控制與它相鄰接的一些lac基因。若將第二個Lac操縱子導入細菌的質粒上,它有自己特有的操縱基因。操縱基因互不干擾。因此如果一個操縱子有一個野生型的操縱基因,在通常條件下,它將被阻遏。當第二個操縱子帶有OC突變時,它將持續表達。
這些特點表明操縱基因是一個典型的順式作用位點。操縱基因只控制與其相鄰接的基因而不影響存在於細胞中的其它DNA上的等位座位。像OC這樣的突變稱為順式-顯性(cis-dominant)。順式作用位點中發生突變就不能和相關蛋白相結合,當兩個順式作用位點彼此靠得很近時(如啟動子和操縱基因),我們通過互補測驗是不能分別突變發生在那一個位點上,而只有通過它們對表型的影響來加以區別。順式顯性是控制鄰接順序的那些DNA位點的特性。如果一個控制位點其功能是作為多順反子mRNA的一部分。它將表現出順式顯性的特點。特別表現在控制位點不能和被它調節的基因相分離。從遺傳學的觀點來看這些位點和基因是在DNA上還是在RNA這並不重要。
lacI-突變型也可導致持續轉錄。無論是點突變還是缺失都可產生這樣的結果。後者可能是丟失了和DNA結合的功能區。因此與誘導物是否存在無關。這種現象是符合負控制系統的。lac+基因編碼一個阻遏蛋白,它可以關閉lacZYA的轉錄。阻遏蛋白失去和操縱基因結合能力時,則為組成型突變。轉錄能在啟動子上自由地起始。同時lacI- 突變由於阻遏蛋白的失活使lacZYA呈組成型表達。
當lacI- 和lacI+二者同時存在於同一個細胞時,通過確定二者的關係可以幫助人們得出正確的結論。這只能通過構建部分二倍體(partial diploid)來完成的。即一個拷貝的操縱子位於細胞的主染色體上,而另一個放在質粒上,此質粒僅帶少量基因,可以獨立複製。
在細胞中若既有lacI+又有lacI-,則可以正常調節。當除去誘導物時,結構基因又重新被阻遏。這表明lacI+可以產正常的阻遏物,當誘導物不存在時它可以反式阻遏lacI ZYA+基因,按遺傳學的觀點野生型的可誘導性對於組成型突變型是顯性的。這是負控制的重要標誌。
操縱子非誘導性突變不能都得到表達,它們可以分成兩種組成型突變:(1) 啟動子突變是順式作用,若這種突變阻礙了RNA聚合酶與Plac的結合,也就不能閱讀操縱子,因為它不能轉錄。(2) lacI突變若阻遏物失去和誘導物結合的能力也會導致和前者相同的現象。這種突變稱為lacIs。
這種反式作用對野生型來說是顯性的。阻遏蛋白被保持在對操縱基因的識別和阻礙轉錄的這種活性狀態中。誘導物是否加入對其沒有影響。這是由於細胞中突變的阻遏物結合在所有的lac操縱基因上並阻斷轉錄,同時還不能取下,野生型阻遏物的存對它也毫無影響。
lacI突變的特點可以從阻遏蛋白結構的得以解釋。在阻遏蛋白上具有兩種不同類型的結合位點。通過這些結合位點來控制基因的表達以對環境作為反應。DNA-結合識別操縱基因。誘導結合位點與小分子誘導物結合。一旦與誘導物作用使其構象發生改變而失去與操縱基因DNA結合的能力。通過lacI突變失去某些活性可以鑑別出阻遏物亞基中的兩個結合位點。DNA-結合位點的突變是組成型的(因為阻遏物不能和DNA結合來阻斷轉錄)。誘導物結合位點的突變是不可誘導性的(由於誘導物不能減少阻遏物和DNA的親和力)。
阻遏物功能的一個重要的特點是多聚體蛋白。在細胞中阻遏蛋白的亞基隨機結合成四聚體。當不同的lacI等位基因存在時,它們的產物作為亞基結合成異聚四聚體,其特性和同聚四聚體不同。這種亞基之間的作用類型是具有多聚體蛋白的性質,被稱為等位基因間的互補(interallelic complementation)。
負的互補(negative complementation)發生在某些阻遏蛋白突變體之間。正如在lacI-d與lacI+基因的重組中所見到的一樣。此lacI-d的突變僅導致阻遏蛋白不能和操縱基因結合。因此它像lacI-等位基因一樣,使操縱子呈組成型表達。由於lacI-類型的突變產生的阻遏物沒有活性,它相對於野生型基因是隱性的,而“-d”這個符號表示負互補這種突變類型是顯性的。這種突變稱反式顯性(trans-dominant),也稱為顯性失活(dominant negatives)。
這種顯性的原因是由於lacI-d等位基因產生一個“壞”的亞基不僅它本身不能結合操縱基因的DNA,而且它還通作為四聚體的一部分阻止四聚體中“好”的亞基與DNA結合。這就意味著阻遏蛋白四聚體是作為一個總體,而不是單個單體的簡單的集合。這對完成阻遏來說是很必要的。在體外將“好”的亞基和“壞”的亞基混合起來也會產生損壞的作用。
lacI-d的突變是發生在阻遏蛋白的DNA結合位點這就可以解釋混合的四聚體可以阻止與操縱基因的結合。結合位點數目的減少使四聚體和操縱基因的親和力減少。lacI基因的左末端對於蛋白產物來說正好是在N-末端DNA-結合位點。lacI-隱性突變發生在此位點以外的任何區域。但可以起到DNA結合的間接作用。
lacIs是不可誘導性突變,它是不能對誘導物作出反應。此可能由於阻遏蛋白失去了誘導物結合位點,或者不能將它們的作用傳遞到DNA-結合位點。lacIS突變位點是很有規律的延著基因成束間隔排列。這些間隔可能存在著肽鏈的改變。
—*—*—*—*—*—*—
R P O Z Y A
①Z、Y、A是指結構基因,用於表達性狀;
lacZ編碼β-半乳糖苷酶,它可以切斷乳糖的半乳糖苷鍵,而產生半乳糖和葡萄糖;
lacY編碼β-半乳糖苷透性酶,它構成轉運系統,將半乳糖苷運入到細胞中;
lacA編碼β-半乳糖苷乙醯轉移酶,只將乙醯-輔酶A上的乙醯基轉移到β-半乳糖苷上;
②R是指調節基因,調節分泌阻遏物或誘導物;
③O是指操縱基因,與乳糖的結合部位;
④P是指啟動子,啟動基因的轉錄和翻譯。