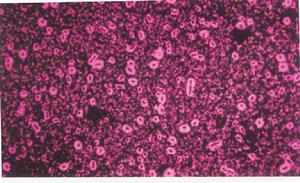
簡介
細菌染色法是為了便於觀察研究而利用有關染料使細菌細胞著色的方法。細菌個體微小,無色透明,因此常採用染色法來觀察其大小和形態結構。染色的基本步驟為塗片→乾燥→固定→染色。常見的染色方法包括簡單染色、負染色、革蘭氏染色、芽孢染色法、鞭毛染色、莢膜染色、死活染色。製備細菌染色片一般要經過塗片、固定、染色、水洗、乾燥等步驟,然後用顯微鏡甚至油鏡觀察。
常用方法有①革蘭氏染色法,是一種復染色方法,即選用結晶紫和石碳酸復紅兩種染液染色的方法,依此將細菌分成革蘭氏陽性菌(記G+)和革蘭氏陰性菌(記G-)。②簡單染色法,是用一種染液染色的方法,如美蘭或石碳酸復紅等,此法只能顯示細菌的形態及大小。③特殊結構染色法,是染色細菌細胞特殊結構,如鞭毛、莢膜、芽孢、異染顆粒等需用的方法 。④負染色法,是指背景著色而細菌本身不著色,常用染料有墨汁、水溶性苯胺黑等,用於檢查細菌的莢膜。⑤螢光染色法,即用螢光染料,如金胺、吖啶類染料進行染色,用於細菌不同部位的形態觀察。
主要類型
革蘭氏染色法
革蘭氏染色法是最常用的鑑別染色法之一。此法起始1881年,染色步驟是先用結晶紫或龍膽紫染液加於已固定好的標本上使之著色,其後加碘液作媒染劑,再用酒精脫色,最後用復紅或沙黃復染。革蘭氏染色的結果與培養基成分、培養條件及操作技術等有密切關係。如塗片太厚影響酒精脫色,革蘭氏陰性菌則可染成革蘭氏陽性菌。脫色時若酒精作用時間太長,革蘭氏陽性菌又會染成革蘭氏陰性菌。在缺乏鎂鹽的培養基中,革蘭氏陽性菌可變成革蘭氏陰性菌。菌齡也能影響染色的結果,這與生長過程中核酸含量的改變有關。革蘭氏染色法的原理還不十分清楚,有化學學說、等電點學說、滲透性學法,目前最通常的解釋是革蘭氏陽性菌在95%酒精中因含粘肽多而導致細胞壁脫水,通透性減低,使在細菌細胞內著色的染料─碘複合物不易透出細胞壁,所以保留了紫色;革蘭氏陰性菌含粘肽少,其細胞壁在95%酒精作用下通透性變化不大,酒精容易進入菌體內溶解染料─碘複合物而透出,失去紫色後被復染成為紅色。
抗酸染色法
有些細菌,如結核桿菌,不般不易著色,一旦染上色後又不易被鹽酸酒精脫色,稱為抗酸菌。主要步驟是將細菌塗片、乾燥、固定後,以石炭酸復紅染液加溫進行染色,然後用含酸的酒精脫色,最後用美藍復染。一般細菌以及標本中的物質都被脫色,抗酸菌則不能,仍為紅色。在藍色背景上呈紅色的細菌即為抗酸菌。
細菌特殊結構的染色法
細菌的特殊結構,如鞭毛、莢膜、細胞壁、芽孢及異染顆粒等,用普通染色法不易著色,故需用特殊染色法。
1、芽孢染色法:部分細菌能產生內孢子,這些孢子能抵制細菌染色液的進入,在革蘭氏染色法塗片染色時,革蘭氏陽性菌的芽孢呈現無色。雖然芽孢在革蘭氏染色片中可以看到,但在不易清晰觀察時,可用特殊的芽孢染色法,使芽孢與菌體呈現不同顏色,便於觀察。主要的芽孢染色法有孔雀綠染色法和石碳酸復紅染色法。
孔雀綠染色法的具體步驟:首先將生有芽孢的斜面菌苔按革蘭氏染色法塗片後,用飽和孔雀綠水溶液染色10min,然後用自來水沖洗,沖洗完後用0.5%蕃紅液復染30s,用水洗,吸乾,即可鏡檢,鏡檢時芽孢呈綠色,菌體和芽孢囊呈微紅色。
石碳酸蕃紅染色法具體步驟:首先按常規塗片,然後滴加石碳酸復紅於塗片上,並於玻片下緩緩加熱,使染液冒蒸汽但不沸騰,並繼續滴加染液,不使塗片上染液蒸乾,這樣保持5min。帶塗片冷卻後,傾去染液,用酸性乙醇脫色指無紅色染劑洗脫為止,接著徹底水洗,洗後用呂氏美藍復染2-3min,水洗吸乾後即可進行鏡檢,鏡檢時菌體計孢囊呈藍色,芽孢呈紅色。
2、鞭毛染色法:鞭毛是細菌的運動器官,非常纖細,超出了光學顯微鏡觀察極限,因此通常情況下在顯微鏡下觀察不到。通過特殊的染色技術,可以將染色液附加到鞭毛的周圍,增加它的直徑,從而能在光學顯微鏡下觀察到鞭毛。鞭毛染色一般分銀鹽法和復紅沉澱法兩種。這裡介紹一下銀鹽沉澱法。用作鞭毛染色的載玻片必須是絕對乾淨無油脂的,將載玻片在火焰上快速灼燒5s,放在染色架上冷卻,用蠟筆分成兩個區域,然後用移液管或者巴斯德移液管吸取2mL無菌水加入到幼齡生長活躍的斜面菌株中,慢慢震盪並旋轉試管使菌株懸浮,儘量避免使用接種環,將懸液轉移到乾淨的試管中,通過懸滴試驗檢查菌體的運動型,用無菌水將懸浮液稀釋至略有渾濁為止,放入20-30℃培養箱中培養30min,然後移取一滿環懸浮液加在已冷卻的載玻片一端,傾斜載玻片讓液滴流到蠟筆畫的中心線,在空氣中自然乾燥。然後用媒染色劑媒染5min之後,慢慢用蒸餾水充分漂洗掉所有的媒染液,用熱的Fontana銀鹽覆蓋,染色5min,每隔1min更換一次染色液(Fontana銀液在沸水浴中加熱),細菌塗層的每一部分都要浸在染色液中,不能裸露。最有用水沖洗,自然晾乾即可進行鏡檢。應當注意一點,染色法的燃料須當日配製,4h內使用,最好是現配現用
3、莢膜染色:一般細菌的莢膜與染色劑的親和性低,但莢膜通透性高,因此染料可以透過莢膜使菌體著色。一般採用負染色方法使背景和菌體之間形成一透明區,將菌體襯托出來便於觀察分辨。莢膜染色的步驟:加一滴6%葡萄糖水溶液在載玻片的一端,無菌操作,挑取細菌斜面上培養72h左右的膠質芽孢桿菌與其混合,加1滴墨汁充分混勻,用推片法製片將菌液鋪成薄層,自然乾燥,滴加1-2滴無水乙醇覆蓋塗片,固定1min,自然乾燥,在已晾乾的塗面上,滴加1%結晶紫染色液染色,2min後用20%的硫酸銅沖洗數次,再用自來水沖洗一次,使用擦鏡紙擦乾後即可鏡檢。有莢膜的菌菌體呈紫色,背景灰黑色,莢膜不著色呈無色透明圈。
負染色法
負染色法是指背景著色而細菌本身不著色。常用墨汁負染色法配合單染色法(如美藍)檢查細菌的莢膜,背景呈黑色,菌體染成藍色,莢膜不著色,包繞在菌體周圍,成為一層透明的空圈。
負染色法常見有兩種操作方法。第一種發個方法比較常見,在一個載玻片上將微生物與異地苯胺黑混合,用另外的載玻片將混合物均勻的覆蓋於原來的載玻片上。該方法的目的是使混合物在在玻片上一邊厚一邊薄,在厚與薄中間的額區域就是最佳觀察區域。第二種方法是用一接種環苯胺黑與微生物混合,用接種針在載玻片的中央將混合物延伸很小的區域。
螢光染色法
用螢光染料,如金胺、吖啶橙等進行染色。細菌用螢光染料著色後在螢光顯微鏡下檢查,可在黑的背景中觀察到細菌發出明亮的螢光。用螢光染色法檢查細菌,有加快檢查速度和提高陽性率等優點。