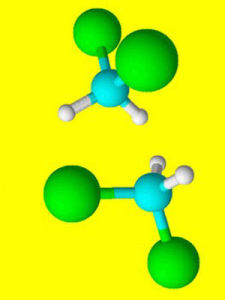
定義
說明
同分異構體又稱 同分異構物。在化學中,是指有著相同分子式的分子;各原子間的化學鍵也常常是相同的;但是原子的排列卻是不同的。也就是說,它們有著不同的“結構式”。許多同分異構體有著相同或相似的化學性質。同分異構現象是 有機化合物種類繁多 數量巨大的原因之一 。
性質
同分異構體的組成和分子量完全相同而分子的結構不同、物理性質和 化學性質也不相同,如乙醇和甲醚【C2H6O】。
同分異構體簡稱 異構體。
有機物中的同分異構體分為 構造異構和 立體異構兩大類。具有相同 分子式,而分子中原子或基團連線的順序不同的,稱為 構造異構。在分子中原子的結合順序相同,而原子或原子團在空間的相對位置不同的,稱為 立體異構。
構造異構又分為 (碳)鏈異構、 位置異構和 官能團異構(異類異構 )。立體異構又分為 構象和構型異構,而構型異構還分為 順反異構和 鏇光異構(又稱對映異構)。
概述
歷史
雷酸銀和 氰酸銀是人類發現的第一個同分異構體。1830年, 柏濟力阿斯提出了一個嶄新的化學概念,叫做“同分異性”。意思是說,同樣的化學成分,可以組成性質不同的化合物。他認為,氰酸與雷酸,便屬於“同分異性”,它們的化學成分一樣,卻是性質不同的化合物。在此之前,化學界一向認為,一種化合物具有一種成分,絕沒有兩種不同化合物具有同一化學成分。
一、書寫規則
“價鍵數守恆”原理:在有機物分子中碳原子的價鍵數為4,氧原子的價鍵數為2,氫原子的價鍵數為1,不足或超過這些價鍵數的結構都是不存在的,都是錯誤的。二、種類
有機物產生同分異構體的本質在於原子的排列順序不同,在中學階段主要指下列三種情況:⑴ 碳鏈異構:由於碳原子的連線次序不同而引起的異構現象,如CH3CH(CH3)CH3和CH3CH2CH2CH3。
⑵官能團位置異構:由於官能團的位置不同而引起的異構現象,如:CH3CH2CH=CH2和CH3CH=CHCH3。
⑶官能團異類異構:由於官能團的不同而引起的異構現象,主要有:
①單烯烴與環烷烴:通式為CnH2n(n≥3)
②二烯烴、單炔烴與環單烯烴:通式為CnH2n-2(n≥3)
③苯及其同系物與多烯:通式為CnH2n-6(n≥6)
④飽和一元醇與飽和一元醚:通式為CnH2n+2O(n≥2)
⑤飽和一元醛、飽和一元酮、烯醇:通式為CnH2nO(n≥3)
⑥飽和一元羧酸、飽和一元酯、羥基醛:通式為CnH2nO2(n≥2)
⑦酚、芳香醇、芳香醚:通式為CnH2n-6O(n≥6)
⑧葡萄糖與果糖;蔗糖與麥芽糖
⑨胺基酸 [R-CH(NH2)-COOH]與硝基化合物(R’-NO2)
例題:
寫出C4H8O2的各種同分異構體(要求分子中只含一個官能團)。
【解析】
根據題意,C4H8O2應代表羧酸和酯,其中羧酸(即C3H7COOH)的種類等於—C3H7的種類,故有
酯必須滿足RCOOR′(R′只能為 烴基,不能為氫原子),R與R′應共含3個碳原子,可能為:
C2—COO—C:
C—COO—C2:
H—COO—C3:
【練習】
已知CH3COOCH2C6H5有多種同分異構體,請寫出其含有酯基和一取代苯結構的所有同分異構體。
三、結構特徵
在烴及其含氧衍生物的分子式中必然含有這樣的信息:該有機物的不飽和度。利用不飽和度來解答這類題目往往要快捷、容易得多。下面先介紹一下不飽和度的概念:設有機物分子中碳原子數為n,當氫原子數等於2n+2時,該有機物是飽和的,小於2n+2時為不飽和的,每少兩個氫原子就認為該有機物分子的不飽和度為1。分子中每產生一個C=C或C=O或每形成一個環,就會產生一個不飽和度,每形成一個C≡C,就會產生兩個不飽和度,每形成一個苯環就會產生4 個不飽和度。
例⒉烴A和烴B的分子式分別為C1134H1146和C1398H1278,B的結構跟A相似,但分子中多了一些結構為的 結構單元。則B分子比A分子多了33 個這樣的結構單元。(註:構成 高分子鏈並決定高 分子結構以一定方式連線起來的原子組合稱之為結構單元。)
四、書寫方法
書寫同分異構體時,關鍵在於書寫的有序性和規律性。例⒊寫出分子式為C7H16的所有 有機物的結構簡式。
【解析】經判斷,C7H16為烷烴
第一步,寫出最長碳鏈:
第二步,去掉最長碳鏈中一個碳原子作為支鏈,餘下碳原子作為主鏈,依次找出支鏈在主鏈中的可能位置(以下相似)
第三步,去掉最長碳鏈中的兩個碳原子,⑴作為兩個支鏈(兩個甲基):
①分別連在兩個不同碳原子上
②分別連在同一個碳原子上
③作為一個支鏈(乙基)
第四步,去掉最長碳鏈中的三個碳原子,
①作為三個支鏈(三個甲基)
②作為兩個支鏈(一個甲基和一個乙基):不能產生新的同分異構體。
最後用氫原子補足碳原子的四個價鍵。
例⒋寫出分子式為C5H10的同分異構體。
【解析】在書寫含 官能團的同分異構體時,通常可按官能團位置異構→ 碳鏈異構→官能團異類異構的順序書寫,也可按其它順序書寫,但不管按哪種順序書寫,都應注意有序思考,防止漏寫或重寫。
⑴按官能團位置異構書寫:
⑵按碳鏈異構書寫:
⑶再按異類異構書寫:
①“成直鏈、一線串”②“從頭摘、掛中間”③“往邊排、不到端”
以C5H12為例,寫出C5H12的各種同分異構
(1)“成直鏈、一線串”:CH3—CH2—CH2—CH2—CH3
(2)“從頭摘、掛中間”:
(3)“往邊排、不到端”:重複上述兩式重複(2)、(3)兩步,可寫出C5H12的另一種同分異構體 ,所以C5H12共有三種同分異構體。
2.書寫各類有機物同分異構體的正確方法
按照官能團異構、碳鏈異構、位置異構的順序來書寫
五、等效氫法
等效氫法判斷烴的一元取代物同分異構體的數目的關鍵在於找出“ 等效氫原子”的數目。“等效氫原子”是指:①同一碳原子上的氫原子是等效的;②同一碳原子所連甲基上的氫原子是等效的;③處於 鏡面對稱位置上的氫原子是等效的(相當於平面成像時,物與像的關係)。
例⒌進行一氯取代反應後,只能生成三種沸點不同的產物的烷烴是(D)
(A)(CH3)2CHCH2CH2CH3(B)(CH3CH2)2CHCH3
(C)(CH3)2CHCH (CH3)2 (D)(CH3)3CCH2CH3
六、如何識別
識別與判斷同分異構體的關鍵在於找出 分子結構的對稱性,在觀察分子結構時還要注意分子的空間構型。例⒍下列事實能夠證明 甲烷分子是正四面體結構,而不是平面正方形結構的是(B)
(A)CH3Cl不存在同分異構體 (B)CH2Cl2不存在同分異構體
(C)CHCl3不存在同分異構體 (D)CH4是非極性分子
例⒎下列事實能說明苯分子的平面正六邊形結構中碳碳鍵不是以單雙鍵交替排列的是(C)
(A)苯的一元取代物沒有同分異構體 (B)苯的間位二元取代物只有一種
(C)苯的鄰位二元取代物只有一種 (D)苯的對位二元取代物只有一種
例⒏萘分子的 結構式可以表示為或,二者是等同的。苯並(a) 芘是強致癌物質(存在於煙囪灰、煤焦油、燃燒菸草的煙霧和內燃機的尾氣中)。它的分子由五個苯環併合而成,其結構式可以表示為(Ⅰ)式或(Ⅱ)式,這兩者也是等同的。
(Ⅰ)(Ⅱ) (A)(B)(C)(D)
現有結構式A~D,其中
⑴跟(Ⅰ)、(Ⅱ)式等同的結構式是(A、D)
⑵跟(Ⅰ)、(Ⅱ)式是同分異構體的是(B)
種數
烷烴同分異構的種類碳原子數 異構體數
1 1
2 1
3 1
4 2
5 3
6 5
7 9
8 18
9 35
10 75
烷基同分異構體數計算公式沒有明確規律,需要記憶,高中階段只要掌握7個碳之內的同分異構體就夠了。
電腦求解
摘要:
本文提出了烷烴同分異構體在計算機中的兩種表示方法,並用來求解輸出指定碳原子個數烷烴的所有同分異構體的分子構造問題。正文:
在種類繁多的 有機化合物中,烴是最簡單的一種。它的特點是只含有碳和氫兩種元素。而烷烴又是烴中構造最簡單的。它的分子中碳原子都是飽和4價的,碳原子之間只以單鍵相互連線,其餘的價則完全與氫原子相連。在計算及表示中只需表示出其碳鏈即可。在多碳原子的烷烴中由於分子中碳鏈構造的不同,同一種烷烴會存在多種同分異構體。例如 丁烷有兩種分子構造:
C
|
C-C-C-C C-C-C
當碳原子數較少時,其同分異構體數量也較少,憑直觀還易於寫出其所有的同分異構體;但當碳原子數增加時,其同分異構體數將迅速增加。
算法
用計算機解決這個問題實際上模擬了人在解決這個問題時的方法。先寫出一個最簡單碳鏈——只有兩個碳原子的碳鏈:1 4
3 C—C 6
2 5
然後可在這個基礎上進一步擴展。具體方法為向這個碳原子加入新的碳原子。現在可供擴展碳原子的位置有六個,可逐一試放。放在一個位置後,與已得到的構造進行比較,如果重複則只算一種;如果構造不同,則把這種新的構造儲存下來。在本例中顯然六個位置放置後都只算同一種。對於四個碳原子的情況,是根據三個碳原子的結果再推算的。在三個碳原子的結構基礎上對新形成的八個空位來試放第四個碳原子,判斷重複性,可得兩個同分異構體。五個碳原子的情況又是由四個碳原子的兩個同分異構體再擴展而來。按這樣的算法,實際上計算N個碳原子的烷烴時都要從三個碳原子的情況一步步推過來
數據結構
1、 碳鏈的計算機表示碳鏈可看作是一種無根樹結構,每一個碳原子作為一個結點。結點下子樹的個數為該結點的度。碳鏈這種樹結構的儲存可用鄰接 矩陣和廣義表兩種方式。
使用鄰接 矩陣來表示各結點之間的連通性。對碳鏈上每個碳原子都編上號。如1號碳原子和2號碳原子相連,則矩陣元素a12和a21均置為1,若無連通關係則置0。例如下面一個碳鏈的鄰接矩陣表示為
1234567
1
2
3
4
5
6
7 0100111
1011000
0100000
0100000
1000000
1000000
1000000
這種表示的優點為擴展碳原子很方便。例如要在上例2號碳原子的右邊再增加一個8號碳原子只需將鄰接矩陣擴展為8階方陣,並置元素a28與a82為1,其餘新增元素為0即可完成。
另一種表示碳鏈的方法是用廣義表。用字元C表示一個碳原子,用“(”和“)”表示層次關係,類似於集合。如上例的碳鏈,用廣義表可表示為
C(C(CC)CCC)
↑ ↑ ↑↑ ↑↑↑
表示碳原子: 1 2 3 4 5 6 7
可見廣義表可直接用一個字元串來表示。這種表示方法的好處為判斷所求碳鏈是否重複時較方便,因為重複的異構體的鄰接矩陣經過一定的算法可轉化成唯一一種廣義表,另外廣義表儲存時也比較方便。
2、樹的兩種儲存結構的互換
由於程式算法在擴展結點時使用鄰接矩陣,判重時使用廣義表,因此兩種儲存結構要相互轉換。
廣義錶轉化為鄰接矩陣相對簡單,可用遞歸過程實現,在此不再贅述。
鄰接矩陣轉化為廣義表時,為了使重複的同分異構體轉化為相同的廣義表,必須對鄰接矩陣進行以下處理:
(1) 按每個結點的度進行由大到小的排序,若度相同,則比較子結點的度的總和。前面例子中的鄰接矩陣即是以排好序的。 (2) 以度最大的第一個結點為根構造廣義表,也可用遞歸方法實現。
同分異構
無機物的同分異構主要出現在配合物中,包括:1.結構異構:
(1)鍵合異構。指同一配位體中,由於有不同的可配位 原子,在形成配合物時,可以通過不同的配位原子進行鍵合而形成不同的配合物。例如-NO2與-ONO,-SCN與-NCS
(2)電離異構。如[Co(SO4)(NH3)5]Br與[CoBr(NH3)5]SO4,它們在水溶液中的電離方式完全不同,因而性質各異。
(3)水和異構。
(4)配位異構。如[Co(en)3][Cr(ox)3]與[Co(ox)3][Cr(en)3],其中配體en(乙二胺)與ox-(草酸根)與不同的中心體形成不同的 結構單元,而形成不同的配合物。
(5)配位位置異構。多出現於多中心配合物。
2.立體異構:
(1)空間幾何異構。包括 順反異構,空間構型不同等。
(2) 鏇光異構。將一種不具有對稱面或對稱中心的配合物通過鏡面反射得道的異構體。它們的物理、 化學性質往往相同,但光學活性有差異。即我們常說的左鏇和右鏇。
例:PtCL4(NH3)2 手性異構