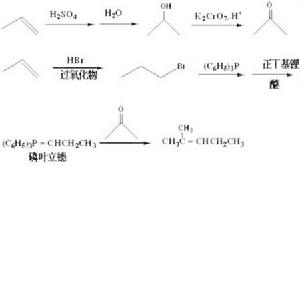
簡介
葉立德
葉立德指的是一類在相鄰原子上有相反電荷的中性分子。葉立德在有機化學,尤其是有機合成中有很多套用。 指由供電子的Lewis結構(類似於配位鍵)形成的正負電荷處於鄰位,且均滿足八電子結構的內鹽分子。通常地,葉立德可以寫成共振式,其中一個共振雜化體具有雙鍵。
最常見的葉立德是磷葉立德。Wittig反應中即是用磷葉立德與羰基化合物反應製得烯烴。通常磷上的正電荷被三個取代的苯基所穩定,而碳則與兩個烷基相連。根據磷葉立德的穩定性不同,大概可將其分為兩類:穩定的一類只與醛反應,而不穩定的一類則與醛和酮都反應。
Corey-Chaykovsky反應中,硫葉立德被用於合成環氧化合物。其中R1,R2是吸電子基。這類葉立德可用N-取代的吖丙啶開環或α-胺基酸與醛縮合製得。
氮葉立德
由於製備胂葉立德所用的三苯胂劇毒,對環境不友好,而氮葉立德由於毒性小、製備所用三級胺來源廣泛且易得,在立體選擇性構建環丙烷體系領域近年來受到越來越多的關注。具有R3P-NR結構的疊氮膦被用於Staudinger反應中。一般認為Tebbe試劑具有部分鈦葉立德的性質。
反應
除了Wittig反應之外,很多葉立德還是1,3-偶極體,可以進行1,3-偶極環加成反應。如亞甲胺葉立德與富勒烯進行Prato反應。
某些磷葉立德也可以進行[3,3]-σ遷移反應。研究表明,Wittig試劑在SN2反應中是親核試劑,消除反應發生於加成反應後。
Wittig-Horner反應
雖然Wittig反應在製備含雙鍵化合物方面具有很大的優越性,但它也有不足之處。比如穩定性亞甲基化膦,一般只能與醛反應,不能與酮反應,特別穩定的亞甲基化膦,甚至不能與最活潑的醛反應,這是由於亞甲基上的取代基團是吸電子基團,如羧酸、羧酸酯、腈等,使亞甲基碳原子的親核性減低,不易同羰基化合物反應的緣故。但是合成含有這些吸電子基團的烯類化合物,在有機合成方面常常是很需要的。為了使亞甲基碳原子的親核性增強,有許多改進Wittig反應的方法,其中最有效的是把磷原子上的苯基用氧或乙氧基取代,也有用胺基取代的,在改良方法中,以亞甲基化膦酸二乙酯負離子法最受重視,也稱為Horner - Emmons改良法,有人把它稱為Wittig-Horner羰基成烯反應。亞甲基化膦酸二乙酯負離子簡稱為Wittig-Horner試劑。Wittig-Horner反應是利用膦酸酯和羰基化合物在鹼存在下成烯。
套用
三元環與雜環直接共用一個碳原子形成螺環結構後,三元環的張力有時會顯著增強,從而開環傾向增大,這使此類螺環丙基雜環化合物成為構建更複雜化合物的一類重要中間體,而且雜環化合物在引入螺環丙基後本身的生理活性也常常會發生顯著的改變,因此螺環丙基雜環化合物的合成方法及其套用一直是一個研究熱點。目前報導構建螺環丙基結構的方法主要有過渡金屬催化的烯烴與疊氮化合物的反應、1,3-偶極環加成、Diels-Alder 反應和Michael 加成後的分子內親核取代等。這些方法得到的產物有時選擇性不是很高,並得到順反異構體的混合物。胂葉立德作為一種構建環丙烷體系的試劑,具有立體選擇性好、反應條件溫和等優點。我們曾經利用胂葉立德實現了螺[環丙烷-1,4'-吡唑啉-5'-酮]衍生物的高立體選擇性合成。但是由於製備胂葉立德所用的三苯胂劇毒, 對環境不友好,而氮葉立德由於毒性小、製備所用三級胺來源廣泛且易得,在立體選擇性構建環丙烷體系領域近年來受到越來越多的關注。在本文中,我們嘗試用1,4-二氮雜雙環【2.2.2】辛烷(DABCO)衍生的氮葉立德,研究螺[環丙烷-1,4'-吡唑啉-5'-酮]衍生物的合成,將結果與用胂葉立德反應的結果進行了比較,並通過反應機理對兩種葉立德的性質對反應的影響做了解釋。
聚乙烯負載的氮葉立德的合成
利用(O-NX) TiCl非茂聚烯烴催化劑實現了乙烯和4-(10-十一烯) -吡啶的共聚合反應,將吡啶基團成功地負載在聚乙烯上,在5%( 摩爾分數) 的負載吡啶和1%(摩爾分數) 的卟啉鐵的催化作用下,此聚合物作為負載型催化劑可以高效地催化重氮化合物與雙拉電子Michael 受體的反應,高產率、高非對映選擇性地得到二氫呋喃衍生物。催化劑至少可以回收使用3 次,反應收率均大於90%。
1 負載型催化劑的合成
在前期研究中發現,(O-NX) TiCl非茂金屬聚乙烯催化劑具有良好的極性單體容忍性,並能催化乙烯與含極性官能團的烯烴單體的共聚合行為,從而高活性地合成含官能團的聚乙烯。同樣利用催化劑4,在MMAO 的助催化下,催化乙烯與4-(10-十一烯) -吡啶共聚合,成功地得到了聚乙烯負載的含吡啶基團的聚合物,用於催化葉立德反應的研究。
2 4-( 10-十一烯) -吡啶催化的二氫呋喃化反應
實驗考察了4-( 10-十一烯) -吡啶催化二氫呋喃化反應,發現在4-( 10-十一烯) -吡啶用量為0. 01 mmol、卟啉鐵用量為0. 002 mmol 以及重氮用量為0. 4 mmol 時,底物( 0. 2 mmol) 能以92%的轉化率及90%的收率得到產物。與文獻。報導的吡啶的催化結果相當。
3 PE-pyridine 用量對反應的影響
由於聚乙烯在溫度高於90 ℃時才能溶解於甲苯中,利用PE-pyridine 催化的化合物的反應需要在90 ℃下進行. 在卟啉鐵用量為0. 002 mmol、PE-pyridine 用量為0. 02 mmol 以及過量的重氮存在下反應時發現,很難避免重氮的偶聯反應。通過條件最佳化,選擇重氮用量為0. 4 mmol,且在稀釋的情況下利用注射泵緩慢滴加至體系中,既可以減少重氮的偶聯,又能保證底物的全部轉化。值得一提的是,即使PE-pyridine 的用量從0. 02 mmol 降至0. 01mmol,甚至0. 004 mmol,反應仍能以高於90%的轉化率得到二氫呋喃化產物,順利地實現了催化反應。反應結束後,通過降低反應體系溫度可使PE-pyridine 從溶液中析出並通過過濾將其從體系中分離出來。
4 底物的普適性
考察了苯環上取代基電性對反應的影響,對位含有拉電子、給電子取代基的底物都能夠很好地反應,並可高產率、高立體選擇性地得到反式產物。而雜環芳烴( 呋喃基) 底物也能夠以86% 的產率以及大於50∶ 1的兩種非對映異構體的比值( DR) 得到呋喃基取代的二氫呋喃化產物。以上結果表明,聚合物能夠很好地實現氮葉立德的催化反應,解決了吡啶的揮發問題,所有反應均能以良好的收率得到單一反式結構的二氫呋喃化產物。根據文獻的工作以及實驗得到結果,提出了以下的反應機理,即重氮被金屬分解成金屬卡賓,接受聚乙烯負載的吡啶的進攻並轉移形成吡啶葉立德。吡啶葉立德對底物進行Micheal 加成,然後氧負離子進攻與吡啶相連的碳,生成四取代二氫呋喃化合物。
5 負載催化劑的回收利用
在卟啉鐵用量為0. 004 mmol、催化劑用量為0. 02 mmol 及重氮用量為0. 8 mmol 的條件下,利用底物( 0. 4 mmol) 進行了催化劑的回收利用實驗。待反應結束冷卻至室溫,過濾後將濾液濃縮,經柱層析提純產物,並將過濾後的固體物質直接用於下一輪反應中。研究結果表明,聚乙烯負載的吡啶催化劑能夠較好地回收利用,3 次回收的情況下反應產率均大於90%。催化效率略有降低,可能是催化劑經幾次回收後有部分被空氣氧化失去催化活性所致,因此反應需要在惰性氣體保護下進行以避免催化劑氧化失活。