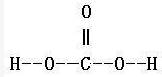理化性質
分子式:H₂CO₃。
結構簡式:HO—CO—OH在CO₂溶於水時形成。
純的碳酸以C(OH)4存在是個不穩定的晶體,遇水劇烈分解。
碳酸酸性極低,其飽和水溶液pH約為5.6,正常雨水ph約為5.6就是因為CO2溶於雨水生成碳酸。其水溶液顯酸性故可以使指示劑變色(可以使石蕊溶液變紅色)。
碳酸是一種二元酸,其電離分為兩步;H₂CO₃⇌HCO₃+HKa1=4.2×10^-7mol/L;pKa1=6.38(25°C)HCO3⇌CO3+HKa2=5.61×10^-11mol/L。pKa2=10.25(25°C)需要注意的是,以上所述值並不適用於實際估算碳酸的酸性,因為單個碳酸分子的酸性比醋酸和甲酸都要強。實際上,碳酸分子只出現在二氧化碳和水的動態平衡中,其濃度比二氧化碳低得多,故酸度實際上較低。
化學方程式
生成和分解
CO2溶於水生成碳酸:CO2+H2O===H2CO3。
碳酸不穩定,在搖晃或加熱時分解為CO2和H2O,方程式為:H2CO3===H2O+CO2↑。
複分解反應
在實驗室里,二氧化碳常用稀鹽酸與大理石(或石灰石,主要成分都是碳酸鈣)反應來製取。反應的化學方程式可以表示如下:CaCO₃+2HCl=CaCl₂+H₂CO(兩種化合物互相交換成分)、(碳酸鈣鹽酸氯化鈣碳酸)。
碳酸不穩定容易分解成二氧化碳和水H₂CO₃===H₂O+CO₂↑。
總的方程式是;CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑(反應有氣體和水生成)該反應符合複分解反應。
特性
 碳酸
碳酸會使紫色石蕊試液變成梅紅色,碳酸顯酸性,酸可使紫色石蕊變色。二氧化碳在溶液中大部分是以微弱結合的水合物形式存在,只有一小部分形成碳酸(H₂CO₃)——飽和CO₂溶液中只有1%的CO2與H2O化合成碳酸。在常溫時,CO2∶H2CO3為600∶1。碳酸的熱穩定性很差。碳酸加熱時全部分解並放出二氧化碳。碳酸在鹼的作用下,能生成酸式碳酸鹽M(HCO3)2和碳酸鹽MCO3〔M代表二價金屬)。許多金屬的酸式碳酸鹽的溶解度稍大於正鹽,其溶解度和Pco2(二氧化碳分壓)有關。Pco2大,碳酸鹽溶解於水;Pco2小(或升溫),析出碳酸鹽,自然界的鐘乳石就是這樣形成的。暫時硬水加熱軟化就是因為生成了碳酸鹽沉澱。所有的酸式碳酸鹽受熱均分解為CO2和相應的正鹽。碳酸是二氧化碳氣體溶於水而生成的酸。它的酸性很弱,且極為不穩定,溫度稍高一些,便會分解成二氧化碳和水。碳酸和我們的日常生活有著密切的關係。我們喝的汽水就是一種碳酸飲料。
在製造汽水時,要在加壓情況下把二氧化碳氣體溶解在水裡,再往汽水裡加糖、檸檬酸以及果汁或香精,在加壓下灌入汽水瓶中。當我們喝汽水時,汽水從瓶子裡倒出來,外界壓強(指空氣壓強和人體內的壓強)突然降低,二氧化碳在水中的溶解度隨著壓強降低而變小。於是,喝入體內汽水中的二氧化碳便成為氣體從水中逸出,並從口腔中排出,這個過程會把人體內的熱量帶走,這就是喝汽水感到涼爽的原因。已製備出純碳酸(碳酸晶體),但條件非常苛刻,要保存在絕對無水的條件下,不然純碳酸會劇烈分解。
危害
有時,碳酸也會給我們日常生活帶來麻煩。地面上的二氧化碳氣體溶於水,生成碳酸。當地面水滲入地下時,碳酸也被帶到地下,並與地下石灰岩里不溶於水的碳酸鈣發生化學反應,生成可溶於水的碳酸氫鈣。含有碳酸氫鈣的水稱為“硬水”,因此地下水都屬於“硬水”。江河裡的水不含碳酸氫鈣,不是“硬水”(硬水是指有較多鈣離子和鎂離子等金屬陽離子,它們的碳酸鹽是不可溶解於水的)。
有些地方所用的自來水的水源是地下水,在煮開水時,水中的碳酸氫鈣受熱分解成碳酸鈣、二氧化碳和水。碳酸鈣是不溶解在水中的沉澱物,它沉積在水壺和鍋爐的壁上,天長日久便成為一層白色的很堅硬的物質,稱為鍋垢(俗稱水鹼)。這層碳酸鈣的導熱性很差,因此燒水時會浪費燃料。如果鍋爐和管道中的鍋垢太厚,還有發生爆炸的危險。所以,工業生產中總是把“硬水”先用化學方法除去或減少碳酸鈣,使它軟化以後再用喔。
有機與無機
碳酸是有機物還是無機物是科學界爭執了很長時間的話題。由於同一個碳原子上連線了兩個羥基,碳酸不穩定,更多顯現無機物的性質,定義碳酸為無機二元弱酸,但碳酸又因含有羧基(-COOH)而能反映一些羧酸的性質。如能和醇發生酯化反應,
如:HO-COOH+H-O-C2H5、HO-COOC2H5+H2O。
HO-COOC2H5+H-O-C2H5、C2H5OCOOC2H5+H2O。
因為碳酸的兩個羥基都結在羰基上,故相當於二元羧酸。可以和二元醇發生酯化反應生成環酯和聚酯。
這些都是有機酸的性質。
科學家仍然對碳酸是否是有機酸爭執,有科學家認為如能製得碳酸的濃溶液,那么這種碳酸具有一切二元羧酸的性質。
無機化學
| 無機化學是除碳氫化合物及其衍生物外,對所有元素及其化合物的性質和他們的反應進行實驗研究和理論解釋的科學,是化學學科中發展最早的一個分支學科。現在讓我們來認識一下這部分化學知識吧。 |