簡介
 氫氣
氫氣氫氣一種重要的工業氣體。無色、無味、無臭、易燃。常壓下沸點-252.8℃,臨界溫度-239.9℃,臨界壓力1.32MPa,臨界密度30.1g/l。在空氣中含量為4%~74%(體積)時,即形成爆炸性混合氣體。氫在各種液體中溶解甚微,難溶於液化。液態氫是無色透明液體,有超導性質。氫是最輕的物質,與氧、碳、氮分別結合成水、碳氫化合物、氨等。天然氣田、煤田以及有機物發酵時也含有少量的氫。
氫氣和一氧化碳的混合氣體是重要的化工原料──合成氣。氫氣在催化劑存在下與有機物的反應稱為加氫,是工業上一種重要的反應過程。
發現
1766年由卡文迪許(H.Cavendish)在英國判明。在化學史上,人們把氫元素的發現與“發現和證明了水是氫和氧的化合物而非元素”這兩項重大成就,主要歸功於英國化學家和物理學家卡文迪許(Cavendish,H.1731-1810)。
 啟普發生器制氫氣
啟普發生器制氫氣18世紀的英國化學家卡文迪許
卡文迪許是一位百萬富翁,但他生活十分樸素,用自己的錢在家裡建立了一座規模相當大的實驗室,一生從事於科學研究。曾有科學史家說:卡文迪許“是具有學問的人中最富的,也是富人當中最有學問的。”他觀察事物敏銳,精於實驗設計,所做實驗的結果都相當準確,而且研究範圍很廣泛,對於許多化學、力學和電學問題以及地球平均密度等問題的研究,都作出了重要發現。但他篤信燃素說,這使他在化學研究工作中走過一些彎路。他在五十年中只發表過18篇論文,除了一篇是理論性的外,其餘全是實驗性和觀察性的。在他逝世以後,人們才發現他寫了大量很有價值的論文稿,沒有公開發表。他的這些文稿是科學研究的寶貴文獻,後來分別由物理學家麥克斯韋和化學家索普整理出版。
在化學史上,有一個與這些論文稿有關的有趣的故事。卡文迪許1785年做過一個實驗,他將電火花通過尋常空氣和氧氣的混合體,想把其中的氮全部氧化掉,產生的二氧化氮用苛性鉀吸收。實驗做了三個星期,最後殘留下一小氣泡不能被氧化。他的實驗記錄保存在留下的文稿中,後面寫道:“空氣中的濁氣不是單一的物質(氮氣),還有一種不與脫燃素空氣(氧)化合的濁氣,總量不超過全部空氣的1/12.一百多年後,1892年,英國劍橋大學的物理學家瑞利(Ragleigh,L.1842-1919)測定氮的密度時,發現從空氣得來的氮比從氨氧化分解產生的氮每升重0.0064克,百思不得其解。化學家萊姆塞(Ramsay,W.1852-1916)認為來自空氣的氮氣裡面能含有一種較重的未知氣體。這時,化學教授杜瓦(Dewar,J.1842-1923)向他們提到劍橋大學的老前輩卡文迪許的上述實驗和小氣泡之謎。他們立即把卡文迪許的科學資料借來閱讀,瑞利重複了卡文迪許當年的實驗,很快得到了小氣泡。萊姆塞設計了一個新的實驗,除去空氣中的水汽、碳酸氣、氧和氮後,也得到了這種氣體,密度比氮氣大,用分光鏡檢查後,肯定這是一種新的元素,取名氬。這樣,卡文迪許當年的工作在1894年元素氬的發現中起了重要作用。從這個故事可看出卡文迪許嚴謹的科研作風和他對化學的重大貢獻。1871年,劍橋大學建立了一座物理實驗室,以卡文迪許的名字命名,這就是著名的卡文迪許實驗室,它在幾十年內,一直是世界現代物理學的一個重要研究中心。
氫的發現和氫的性質的研究
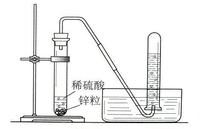 實驗室製取氫氣
實驗室製取氫氣在18世紀末以前,曾經有不少人做過製取氫氣的實驗,所以實際上很難說是誰發現了氫,即使公認對氫的發現和研究有過很大貢獻的卡文迪許本人也認為氫的發現不只是他的功勞。早在16世紀,瑞士著名醫生帕拉塞斯就描述過鐵屑與酸接觸時有一種氣體產生;17世紀時,比利時著名的醫療化學派學者海爾蒙特(van Helmont,J.B.1579-1644)曾偶然接觸過這種氣體,但沒有把它離析、收集起來。
波義耳雖偶然收集過這種氣體,但並未進行研究。他們只知道它可燃,此外就很少了解。1700年,法國藥劑師勒梅里(Lemery,N.1645-1715)在巴黎科學院的《報告》上也提到過它。最早把氫氣收集起來,並對它的性質仔細加以研究的是卡文迪許。
1766年卡文迪許向英國皇家學會提交了一篇研究報告《人造空氣實驗》,講了他用鐵、鋅等與稀硫酸、稀鹽酸作用製得“易燃空氣”(即氫氣),並用普利斯特里發明的排水集氣法把它收集起來,進行研究。他發現一定量的某種金屬分別與足量的各種酸作用,所產生的這種氣體的量是固定的,與酸的種類、濃度都無關。他還發現氫氣與空氣混合後點燃會發生爆炸;又發現氫氣與氧氣化合生成水,從而認識到這種氣體和其它已知的各種氣體都不同。但是,由於他是燃素說的虔誠信徒,按照他的理解:這種氣體燃燒起來這么猛烈,一定富含燃素;硫磺燃燒後成為硫酸,那么硫酸中是沒有燃素的;而按照燃素說金屬也是含燃素的。所以他認為這種氣體是從金屬中分解出來的,而不是來自酸中。他構想金屬在酸中溶解時,“它們所含的燃素便釋放出來,形成了這種可燃空氣”。他甚至曾一度構想氫氣就是燃素,這種推測很快就得以當時的一些傑出化學家舍勒、基爾萬(Kirwan,R.1735-1812)等的贊同。由於把氫氣充到膀胱氣球中,氣球便會徐徐上升,這種現象當時曾被一些燃素學說的信奉者們用來作為他們“論證”燃素具有負重量的根據。但卡文迪許究竟是一位非凡的科學家,後來他弄清楚了氣球在空氣中所受浮力問題,通過精確研究,證明氫氣是有重量的,只是比空氣輕很多。他是這樣做實驗的:先把金屬和裝有酸的燒瓶稱重,然後將金屬投入酸中,用排水集氣法收集氫氣並測體積,再稱量反應後燒瓶及內裝物的總量。這樣他確定了氫氣的比重只是空氣的9%.但這些化學家仍不肯輕易放棄舊說,鑒於氫氣燃燒後會產生水,於是他們改說氫氣是燃素和水的化合物。
 盛有氫氣的集氣瓶的放置方法
盛有氫氣的集氣瓶的放置方法水的合成否定了水是元素的錯誤觀念,在古希臘:恩培多克勒提出,宇宙間只存在火、氣、水、土四種元素,它們組成萬物。從那時起直到18世紀70年代,人們一直認為水是一種元素。1781年,普利斯特里將氫氣和空氣放在閉口玻璃瓶中,用電火花引爆,發現瓶的內壁有露珠出現。同年卡文迪許也用不同比例的氫氣與空氣的混合物反覆進行這項實驗,確認這種露滴是純淨的水,表明氫是水的一種成分。這時氧氣業已發現,卡文迪許又用純氧代替空氣進行試驗,不僅證明氫和氧化合成水,而且確認大約2份體積的氫與1份體積的氧恰好化合成水(發表於1784年)。這些實驗結果本已毫無疑義地證明了水是氫和氧的化合物,而不是一種元素,但卡文迪許卻和普利斯特里一樣,仍堅持認為水是一種元素,氧是失去燃素的水,氫則是含有過多燃素的水。他用下式表示“易燃空氣”(氫)的燃燒:(水+燃素)+ (水-燃素)—→水,易燃空氣(氫) 失燃素空氣(氧),1782年,拉瓦錫重複了他們的實驗,並用紅熱的槍筒分解了水蒸汽,明確提出正確的結論:水不是元素而是氫和氧的化合物,糾正了兩千多年來把水當做元素的錯誤概念。1787年,他把過去稱作“易燃空氣”的這種氣體命名為“H-ydrogne”(氫),意思是“產生水的”,並確認它是一種元素。
名稱由來
希臘語 hydro(水)+genes(造成),意即“產生水”的物質。中文原稱“氫氣”為“輕氣”,“氫”屬以後新造的形聲字。
日語及朝鮮語循希臘語原義,稱為“水素”。
主要分布
在地球上和地球大氣中只存在極稀少的游離狀態氫。在地殼里,如果按重量計算,氫只占總重量的1%,而如果按原子百分數計算,則占17%。氫在自然界中分布很廣,水便是氫的“倉庫”——以重量百分比計算,水中含11%的氫;泥土中約有1.5%的氫;石油、天然氣、動植物體也含氫。在空氣中,氫氣倒不多,約占總體積的兩百萬分之一。在整個宇宙中,按原子百分數來說,氫卻是最多的元素。據研究,在太陽的大氣中,按原子百分數計算,氫占93%。在宇宙空間中,氫原子的數目比其他所有元素原子的總和約大100倍。
工業氫純度
工業氫(GB/T3634.1-2006) | |||
項目名稱 | 優等品 | 一等品 | 合格品 |
| 氫氣(H2)的體積分數/10-2≥ | 99.95 | 99.5 | 99 |
| 氧(O2)的體積分數/10-2≤ | 0.01 | 0.2 | 0.4 |
| 氮加氬(N2+Ar)的體積分數/10-2≤ | 0.04 | 0.3 | 0.6 |
| 露點/℃≤ | -43 | — | — |
| 游離水/(ml/40L瓶) | — | 無游離水 | ≤100 |
註:管道輸送以及其他包裝形式的合格品工業氫的水分指標由供需雙方確定 | |||
物理性質
 Hydrogen
Hydrogen氫氣是無色並且密度比空氣小的氣體(在各種氣體中,氫氣的密度最小。標準狀況下,1升氫氣的質量是0.0899克,比空氣輕得多)。因為氫氣難溶於水,所以可以用排水集氣法收集氫氣。另外,在101千帕壓強下,溫度-252.87℃時,氫氣可轉變成無色的液體;-259.1℃時,變成雪狀固體。常溫下,氫氣的性質很穩定,不容易跟其它物質發生化學反應。但當條件改變時(如點燃、加熱、使用催化劑等),情況就不同了。
總結為:
分子式:H2
沸點:-252.77℃(20.38K)
密度:0.09kg/m3
相對分子質量:2.016
生產方法:電解,裂解,煤制氣等。
主要性能
可燃性
純氫的引燃溫度為400℃。在帶尖嘴的導管口點燃純淨的氫氣,觀察火焰的顏色。然後在火焰上方罩一個冷而乾燥的燒杯,過一會兒,我們可以看到,純淨的氫氣在空氣里安靜地燃燒,產生淡藍色的火焰(氫氣在玻璃導管口燃燒時,火焰常略帶黃色)。用燒杯罩在火焰的上方時,燒杯壁上有水珠生成,接觸燒杯的手能感到發燙。
 氫氣燃燒
氫氣燃燒氫氣在空氣里燃燒,實際上是氫氣跟空氣里的氧氣發生了化合反應,生成了水並放出大量的熱。這個反應的化學方程式是:
2H2+O2=2H2O(點燃)
取一個一端開口,另一端鑽有小孔的紙筒(或塑膠筒等),用紙團堵住小孔,用向下排空氣法收集氫氣,使紙筒內充滿氫氣。把氫氣發生裝置移開,拿掉堵小孔的紙團,用燃著的木條在小孔處點火,注意有什麼現象發生。做這個實驗時,人要離得遠些,注意安全。
可以看到,剛點燃時,氫氣安靜地燃燒,過一小會兒,突然聽到“砰”的一聲響,爆炸的氣浪把紙筒高高掀起。實驗測定,空氣里如果混入氫氣的體積達到總體積的4%~74.2%,點燃時就會發生爆炸。這個範圍叫做氫氣的爆炸極限。實際上,任何可燃氣體或可燃的粉塵如果跟空氣充分混合,遇火時都有可能發生爆炸。因此,當可燃性氣體(如氫氣、液化石油氣、煤氣等)發生泄漏時,應杜絕一切火源、火星,以防發生爆炸。
正是由於這個原因,我們在使用氫氣時,要特別注意安全。點燃氫氣前,一定要檢驗氫氣的純度。用排水法收集一試管氫氣,用拇指堵住,移近火焰,移開拇指點火,如果聽到尖銳的爆鳴聲,就表明氫氣不純,需要再收集,再檢驗,直到響聲很小,才表明氫氣已純淨。如果用向下排空氣法收集氫氣,經檢驗不純而需要再檢驗時,應該用拇指堵住試管口一會兒,看是否有“噗”聲,直到試驗表明氫氣純淨為止。然後再收集氫氣檢驗純度,否則會發生危險。因為剛檢驗過純度的試管內,氫氣火焰可能還沒有熄滅,如果立刻就用這個試管去收集氫氣,氫氣火焰可能會點燃氫氣發生器里尚混有空氣的氫氣,使氫氣發生器發生爆炸。用拇指堵住試管口一會兒,就使試管內未熄滅的氫氣火焰因缺氧氣而熄滅。
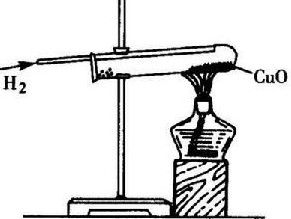 氫氣還原氧化銅
氫氣還原氧化銅這一反應過程中有大量熱放出,是相同條件下汽油的三倍。因此可用作高能燃料,在火箭上使用。我國長征3號火箭就用液氫燃料。
還原性
氫氣與氧化銅反應,實質是氫氣奪取氧化銅中的氧生成水,使氧化銅變為紅色的金屬銅。
CuO H2=Cu H2O(加熱)
根據氫氣所具有的燃燒性質,它可以作為燃料,可以套用與航天、焊接、軍事等方面;根據它的還原性,還可以用於冶煉某些金屬材料等方面。
生產方法
工業上生產純氫及將含氫氣體提純的主要方法有以下幾種:
 氫氣
氫氣①電解法
將水電解得氫氣和氧氣。氯鹼工業電解食鹽溶液製取氯氣、燒鹼時也副產氫氣。電解法能得到純氫,但耗電量很高,每生產氫氣1m3 ,耗電量達21.6~25.2MJ。
②烴類裂解法
此法得到的裂解氣含大量氫氣,其含量視原料性質及裂解條件的不同而異。裂解氣深冷分離得到純度90%的氫氣,可作為工業用氫,如作為石油化工中催化加氫的原料。
③烴類蒸汽轉化法
烴類在高溫和催化劑存在下,可與水蒸氣作用製成含氫的合成氣。為了從合成氣中得到純氫,可採用分子篩通過變壓吸附除去其他氣體;也可採用膜分離得到純氫;用金屬鈀吸附氫氣,可分離出氫氣體積達金屬的1000倍。
生產過程中產生的各種含氫氣體,如催化裂化、催化重整、石油焦化等過程產生的含氫氣體,以及焦爐煤氣(含氫45%~60%)經過深冷分離,可得純度較高的工業氫氣。
純化
隨著半導體工業、精細化工和光電纖維工業的發展,產生了對高純氫的需求。例如,半導體生產工藝需要使用99.999%以上的高純氫。但是目前工業上各種制氫方法所得到的氫氣純度不高,為滿足工業上對各種高純氫的需求,必須對氫氣進行進一步的純化。氫氣的純化方法大致可分為兩類(物理法和化學法),六種方法。
氫氣的純化方法:
| 方法 | 基本原理 | 適用原料氣 | 製得的氫氣純度(%) | 適用規格 |
| 高壓催化法 | 氫與氧發生催化反應而除去氧 | 含氧的氫氣,主要為電解法製得的氫氣 | 99.999 | 小 |
| 金屬氫化物分離法 | 先使氫與金屬形成金屬氫化物後,加熱或減壓使其分解 | 氫含量較低的氣體 | >99.9999 | 中小 |
| 高壓吸附法 | 吸附劑選擇吸附雜質 | 任何含氫氣體 | 99.999 | 大 |
| 低溫分離法 | 低溫下使氣體冷凝 | 任何含氫氣體 | 90~98 | 大 |
| 鈀合金薄膜擴散法 | 鈀合金薄膜對氫有選擇滲透性,而其他氣體不能透過 | 氫含量較低的氣體 | >99.9999 | 中小 |
| 聚合物薄膜擴散法 | 氣體通過薄膜的擴散速率不同 | 煉油廠廢氣 | 92~98 | 小 |
同位素
在眾多元素中,只有氫的同位素擁有不同名稱。在自然界中存在的同位素有: 氕(piē,ㄆㄧㄝ)(1H)、氘(dāo,ㄉㄠ)(2H,D,重氫)、氚(chuān,ㄔㄨㄢ)(3H,T,超重氫)
工業用途
氫氣的最初用途是制氫氣球、氫氣飛艇。目前,全世界生產的氫氣有三分之二用於制合成氨。其次,是用於石油煉製和石油化工的各種工藝過程,如加氫裂化、催化加氫、加氫精制、加氫脫硫、苯加氫制環己烷、萘加氫制十氫萘等。第三是生產甲醇。此外,氫氣還用於動植物油脂的硬化,如製造人造奶油、脆化奶油、潤滑脂等。
 氫氣感測器
氫氣感測器許多化學品的生產都要消耗氫,例如氫氣與氯氣合成氯化氫(其水溶液為鹽酸),氫與某些有機物作用生成醇、醛、醋酸、胺等。
 氫氣感測器DH4
氫氣感測器DH4氫是主要的工業原料,也是最重要的工業氣體和特種氣體,在石油化工、電子工業、冶金工業、食品加工、浮法玻璃、精細有機合成、航空航天等方面有著廣泛的套用。同時,氫也是一種理想的二次能源( 二次能源是指必須由一種初級能源如太陽能、煤炭等來製取的能源)。在一般情況下,氫極易與氧結合。這種特性使其成為天然的還原劑使用於防止出現氧化的生產中。在玻璃製造的高溫加工過程及電子微晶片的製造中,在氮氣保護氣氛中加入氫以去除殘餘的氧。在石化工業中,需加氫通過去硫和氫化裂解來提煉原油。氫的另一個重要的用途是對人造黃油、食用油、洗髮精、潤滑劑、家庭清潔劑及其它產品中的脂肪氫化。由於氫的高燃料性,航天工業使用液氫作為燃料。
套用行業
 氫氣
氫氣石油精煉
浮法玻璃
電子
食品
化工生產
航天
汽車業
儲存運輸
包裝:氫氣拖車/瓶組/鋼瓶,氫的貯運有四種方式可供選擇,即氣態貯運、液態貯運、金屬氫化物貯運和微球貯運。目前,實際套用的只有前三種,微球貯運方式尚在研究中。安全環保
氫氣是一種無色、無嗅、無毒、易燃易爆的氣體,和氟、氯、氧、一氧化碳以及空氣混合均有爆炸的危險,其中,氫與氟的混合物在低溫和黑暗環境就能發生自發性爆炸,與氯的混合比為1:1時,在光照下也可爆炸。氫由於無色無味,燃燒時火焰是透明的,因此其存在不易被感官發現,在許多情況下向氫氣中加入乙硫醇,以便感官察覺,並可同時付予火焰以顏色。氫雖無毒,在生理上對人體是惰性的,但若空氣中氫含量增高,將引起缺氧性窒息。與所有低溫液體一樣,直接接觸液氫將引起凍傷。液氫外溢並突然大面積蒸發還會造成環境缺氧,並有可能和空氣一起形成爆炸混合物,引發燃燒爆炸事故。
科學家用農業廢棄物製取燃料氫氫作為一種清潔能源已被廣泛重視,並普遍作為燃料電池的動力源,然而製取氫的傳統方法成本高,技術複雜。美國研究人員日前開發出一種利用木屑或農業廢棄物的纖維素製取氫的技術,有望解決氫製取費用高的難題。
石油衍生品
潤滑劑 | 石蠟 | 瀝青 | 石油焦 | 煤油 | 柴油 | 機油 | 潤滑油 | 齒輪油 | 液壓油 | 汽輪機油 | 電器絕緣油 | 壓縮機油 | 乙烯|丙烯 | 合成氨 | 氫氣 | 乙炔 | 碳黑|潤滑油[機械工程學術語]|液化石油氣|

