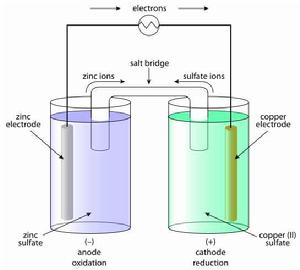
簡介
鋅銅電池,有時也根據其發明者的名字約翰·弗雷德里克·丹尼爾而稱為丹尼爾電池。這是一種以鋅為負極,銅為正極的蓄電池,其化學反應式如下:
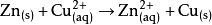 鋅銅電池
鋅銅電池 鋅銅電池
鋅銅電池熱力學理論
 鋅銅電池
鋅銅電池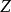 鋅銅電池
鋅銅電池在熱力學裡,電動勢 乘以電荷量 ,就是分離電荷所做的功項目。對於可逆過程,當電動勢促使電荷在電池內移動時,內能的變化包括這項目:
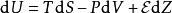 鋅銅電池
鋅銅電池其中,U 是內能, S 是熵, T 是絕對溫度,V 是體積, P 是壓強。
假設電池為丹尼耳電池,由於在這種電池內進行的反應不會產生氣體,系統體積不變,方程式簡化為
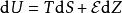 鋅銅電池
鋅銅電池讓熵 S 為T 和 Z 的函式,熵的全微分為
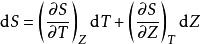 鋅銅電池
鋅銅電池假設等溫過程,那么,方程式右手邊的第一個項目等於零:
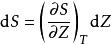 鋅銅電池
鋅銅電池將這方程式帶入內能的方程式:
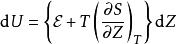 鋅銅電池
鋅銅電池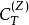 鋅銅電池
鋅銅電池這方程式右手邊的第二個項目是“充電熱”(heat of charging),定義為在一個等溫可逆的充電過程,系統的熱能吸收率 :
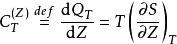 鋅銅電池
鋅銅電池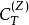 鋅銅電池
鋅銅電池吸收率 比較不容易計算,可以找更有用的變數替換。思考亥姆霍茲自由能 F :
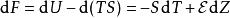 鋅銅電池
鋅銅電池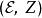 鋅銅電池
鋅銅電池所以, 是一對共軛變數(Conjugate variables)。其馬克士威關係式為:
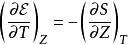 鋅銅電池
鋅銅電池帶入內能的方程式:
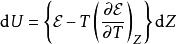 鋅銅電池
鋅銅電池通常,電動勢跟溫度T 、電荷量 Z 有關。假若,能夠使丹尼耳電池內的溶液保持飽和狀態,有很多離子化合物隨時準備分解進入溶液,則電動勢跟電荷量無關,只跟溫度有關:
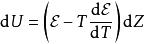 鋅銅電池
鋅銅電池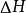 鋅銅電池
鋅銅電池對於丹尼耳電池,體積不變,假設等壓過程,則焓的改變 ,稱為“反應熱”,等於內能的改變:
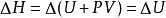 鋅銅電池
鋅銅電池使得一莫耳的金屬原子進入溶液所需要的電荷量為
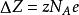 鋅銅電池
鋅銅電池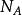 鋅銅電池
鋅銅電池其中, z 是金屬離子的電價, 是亞佛加厥常數, e 是基本電荷量。
假設恆壓、恆體積,則電池的熱力學性質與電動勢的緊密關係,以方程式表達為
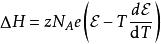 鋅銅電池
鋅銅電池這樣,只要得到電動勢與溫度之間關係的資料,從測量電動勢和溫度的數據,很容易就能夠準確地計算出某化學反應的反應熱。