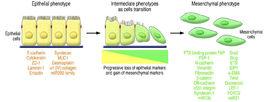
分類
在2007年舉行的國際EMT會議和2008年冷泉港(Cold Spring Harbor)實驗室會議上,以EMT發生的特定生物學環境為依據將其分為。
1型
與胚胎植入、發育和器官形成相關的EMT稱為1型EMT。其主要生物學功能是通過間充質細胞上皮化(MET)過程產生次級上皮細胞,實現胚胎形成過程中的細胞類型多樣化。
2型
與損傷修復、組織再生和器官纖維化相關的EMT被定義為2型EMT。其主要生物學作用是通過產生纖維細胞以修復由創傷和炎症反應造成的組織損傷。生理狀態下,當炎症反應緩解後該轉化過程即自行停止;然而在炎症反應持續活化的情況下,EMT過程也將持續存在,並最終造成器官纖維化。
3型
3型EMT是指與上皮細胞惡性腫瘤相關的表型轉化。原發性上皮組織腫瘤細胞通過3型EMT形成具有遷移能力的間充質細胞,隨血流轉移至不同部位,進而通過EMT過程形成上皮細胞的腫瘤轉移灶。與1型和2型EMT所形成的完全喪失上皮細胞表型的間充質細胞不同的是,3型EMT形成的轉移性腫瘤細胞在獲得間充質表型的同時保持一定的上皮細胞的特性。
信號轉導通路
1型
Wnts和Notch信號通路。
細胞表面蛋白(E-cadherin↓ N-cadherin↑)
2型
炎症反應造成的腎臟損傷由其募集的多種類型細胞所介導,其中主要包括巨噬細胞和活化的成纖維細胞。上述細胞通過釋放大量生長因子、趨化因子和基質蛋白酶,活化包括Smads通路、ERK-MAPK通路、PI3K-AKT通路在內的多條信號轉導徑路啟動2型EMT。
細胞骨架蛋白(成纖維特異性蛋白1,FSP1),細胞表面蛋白(E-cadherin↓ OB-cadherin↑),細胞外基質蛋白(層連蛋白↓ 纖連蛋白↑)
3型
在原發腫瘤的形成過程中,主要存在5條信號通路,包括酪氨酸激酶受體徑路、整合素徑路、Wnts徑路、NF-kB徑路和TGF-b徑路(涉及smads/AKT/GSK3/Rho-GTP酶等信號分子)。
轉錄因子:Snail因子,特別是Snail1和Snail2的上調錶達可以作為3型EMT的共同生物標誌物。
Twist在早期的胚胎形成、組織纖維化和腫瘤轉移過程中也存在上調錶達。在3型EMT形成的轉移性惡性腫瘤細胞中,Twist具有獨立的抑制E鈣粘蛋白表達並上調纖連蛋白和N鈣粘蛋白的作用。
MicroRNA(miR200s,miR205等)
研究進展
上皮間充質轉化,特別是3型上皮間充質轉化近年研究較熱。由於上皮性腫瘤在惡性腫瘤中所占比例及其轉歸預後較差,探究上皮細胞在獲得去分化遷移侵襲能力的過程,即上皮間充質轉化過程,為腫瘤的控制提供了方向。
E-cadherin
細胞在上皮間充質過程中上皮極性和細胞連線缺失,經研究證實,E-cadherin可維持細胞間緊密連線,阻止細胞活動侵襲及轉移擴散。相反地,培養的上皮細胞E-cadherin轉基因小鼠模型或表達敲出證實了低E-cadherin表達可誘導EMT發生。Cadherin的表達可以在轉錄、翻譯、翻譯後蛋白降解等多水平進行調節,在不同的人體腫瘤中,E-cadherin的功能缺失可由基因突變產生的蛋白異常、異常的轉錄後修飾(磷酸化或糖基化)和增加的蛋白水解所致。例如,轉錄因子Snail-1,Snail-2,Zeb-1,Zeb-2,Twist的影響;啟動子超甲基化所致轉錄水平沉默等。
zeb1
zeb1作為EMT最關鍵的轉換分子 ,其表達可以抑制mir-200b/a/429,而mir-200b/a/429也可以做為抑制因子抑制zeb1的表達。
microRNA
microRNA是進化過程中高度保守的長度在19-24個核苷酸的RNA分子,它能夠通過與mRNA的特異性結合,在轉錄後水平影響基因表達。據估計miRNA能顧影響人體內30%的蛋白表達。在腫瘤發生過程中,miRNA可以通過自身的上調和下調分別行使原癌基因和抑癌基因的作用。它也可影響腫瘤細胞對於細胞抑制劑或輻射的敏感性。
上皮間充質轉化中miRNA的複雜調節可以通過miR-200家族(miR-200a,miR-200b,miR-200c,miR-141及miR-429)的例子來闡明。 miR-200家族抑制轉錄因子Zeb-1和Zeb-2(E-cadherin的轉錄因子)的表達,相反地,Zeb-1和Zeb-2抑制miR-200的表達。換言之,miR-200通過反饋調節抑制EMT過程。也有研究證實,在人類乳腺癌細胞系,miR-200上調促進轉移,提示在細胞轉移過程不同進程中,miR-200成員發揮的作用不同。並且,Notch配體Jagged2通過抑制轉錄因子GATA3的表達促進腫瘤轉移,GATA3也可抑制miR-200進而促進腫瘤轉移,故言之,miR-200與GATA3也屬於反饋抑制調節。
miR-9也可直接影響E-cadherin的表達。部分miRNA可通過靶向EMT中的轉錄因子,例如Snail,Zeb等,或調節其中信號通路影響腫瘤轉移。舉例說明,抑癌基因p53可誘導 miR-34a和 miR-192的表達,進而抑制Snail-1和Zeb-2的表達,阻止EMT進程。 miR-138可抑制ZEb-2進而抑制EMT。 miR-194抑制Bmi,而Twist-1誘導Bmi活化EMT。 miR-27直接阻斷腫瘤抑制基因APC的表達,進而促進EMT。
最新展望
考慮到在腫瘤遷移和侵襲過程重要性,EMT是腫瘤轉化瀑布中重要的一步。儘管目前對於EMT機制理解已經有了進展,目前,我們還未研製出完善地EMT靶向腫瘤治療藥物。抑制血管內皮生長因子受體(EGFR)活性藥物(匹配依賴性上調EGFR的腫瘤類型)已投入臨床套用,但其效果尚未完成特異性評估,並且,此類藥物往往也會走向復發的最終結局。靶向針對EMT過程中不同的受體(包括血管內皮生長因子受體EGFR,胰島素樣生長因子1型受體IGF1R,PDGFR,FGFR等)賴氨酸激酶活性的新型藥物,尚處於I期臨床試驗或者臨床前測試中。這類研究中的主要問題在於,目前缺乏治療過程中對於腫瘤轉移的特異性無創傷標記。我們相信,對於EMT和腫瘤轉移的研究將會為惡性腫瘤治療開闢新的視野。